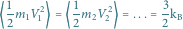Co to jest?
Marian Smoluchowski
Ruchy Browna (I)
Pogląd, iż ciała makroskopowe zbudowane są z drobnych składników jakimi są atomy i molekuły jest dzisiaj przyjmowany przez wszystkich fizyków za oczywisty. Stosując metody fizyki statystycznej możemy na podstawie praw rządzących ruchem tych składników wyprowadzić między innymi prawa termodynamiki, wyliczyć ciepło właściwe różnych substancji, ich podatność magnetyczną, opór elektryczny itp. Podstawy fizyki statystycznej zwanej dawniej teorią kinetyczno-molekularną zostały sformułowane w drugiej połowie XIX w. w pracach Clausiusa, Maxwella, Boltzmanna i Gibbsa...
Potrafili oni wykazać, że przyjęcie hipotezy o atomowej strukturze materii pozwala na jakościowe wyjaśnienie zjawisk makroskopowych i otrzymanie zgodnych z doświadczeniem wyników ilościowych. Mimo to większość ówczesnych fizyków nie wierzyła w istnienie atomów. Na potwierdzenie można przytoczyć dwa spektakularne fakty. L. Boltzmann pisząc podręcznik teorii kinetycznej (wydany w 1908 r.) podał we wstępie jako cel swojej pracy uratowanie od zapomnienia dotychczasowych osiągnięć tej teorii. M. Planck, po początkowych niepowodzeniach w próbach rozwiązania problemu promieniowania ciała doskonale czarnego na gruncie termodynamiki i elektrodynamiki, sięgnął po statystyczną interpretację II zasady termodynamiki. Swoją decyzję nazwał "aktem desperacji".

Ruch Browna ziarenek zawieszonych w cieczy.
Kiedy zatem społeczność fizyków przekonała się ostatecznie do hipotezy atomowej?
Stało się to na początku XX wieku. Przełomowym momentem było zakończenie sukcesem zmagań z problemem tzw. ruchów Browna. Warto przypomnieć historię tych zmagań. W roku 1828 szkocki botanik Robert Brown opublikował sprawozdanie ze swoich obserwacji dokonanych latem poprzedniego roku. Posługując się mikroskopem z nowym wówczas obiektywem achromatycznym zaobserwował, iż zawieszone w cieczy drobne pyłki kwiatowe o rozmiarach rzędu  wykonują nieustanne, nieregularne ruchy podobne do błądzenia. Dość szybko okazało się, że ruchy takie były obserwowane dużo wcześniej przez innych uczonych (m.in. przez Leeuwenhoeka w 1650 r.), ale nie poświęcili im oni większej uwagi i w przeciwieństwie do Browna nie rozpoczęli nad nimi systematycznych badań. Początkowo Brown przypuszczał, że ma do czynienia z objawami życia. Przypuszczenie to wydawało się zrozumiałe, skoro przedmiotem jego zainteresowania były pyłki kwiatowe. Nie mogło być jednak utrzymane. Brown bowiem po zbadaniu zawiesin pyłków wielu roślin, między innymi przechowywanych w zielniku sto i więcej lat, uczynił krok następny, zaczął obserwować zawiesiny rozdrobnionych minerałów, początkowo organicznych, później nieorganicznych. Badał dosłownie wszystko, od sadzy z kominów londyńskich przez kawałki szkła do... odłamków Sfinksa. W każdym przypadku, niezależnie od rodzaju substancji, o ile tylko była ona dostatecznie rozdrobniona, występowały charakterystyczne nieregularne ruchy ziarenek zawieszonych w cieczy. Po wielokrotnym powtarzaniu eksperymentów Brown doszedł do wniosku, że ziarenka te poruszają się "same z siebie".
wykonują nieustanne, nieregularne ruchy podobne do błądzenia. Dość szybko okazało się, że ruchy takie były obserwowane dużo wcześniej przez innych uczonych (m.in. przez Leeuwenhoeka w 1650 r.), ale nie poświęcili im oni większej uwagi i w przeciwieństwie do Browna nie rozpoczęli nad nimi systematycznych badań. Początkowo Brown przypuszczał, że ma do czynienia z objawami życia. Przypuszczenie to wydawało się zrozumiałe, skoro przedmiotem jego zainteresowania były pyłki kwiatowe. Nie mogło być jednak utrzymane. Brown bowiem po zbadaniu zawiesin pyłków wielu roślin, między innymi przechowywanych w zielniku sto i więcej lat, uczynił krok następny, zaczął obserwować zawiesiny rozdrobnionych minerałów, początkowo organicznych, później nieorganicznych. Badał dosłownie wszystko, od sadzy z kominów londyńskich przez kawałki szkła do... odłamków Sfinksa. W każdym przypadku, niezależnie od rodzaju substancji, o ile tylko była ona dostatecznie rozdrobniona, występowały charakterystyczne nieregularne ruchy ziarenek zawieszonych w cieczy. Po wielokrotnym powtarzaniu eksperymentów Brown doszedł do wniosku, że ziarenka te poruszają się "same z siebie".
Praca Browna wzbudziła szerokie zainteresowanie, przedrukowały ją wszystkie poważniejsze pisma naukowe. Powszechnie krytykowano myśl Browna o samoistności wspomnianych ruchów. Proponowano różnego rodzaju wytłumaczenia. Przypuszczano, że powodem ruchów mogą być: różnice temperatur w silnie oświetlonej cieczy, parowanie, prądy powietrza, przepływ ciepła, zjawiska związane z napięciem powierzchniowym, oddziaływanie między cząsteczkami zawiesiny, drgania spowodowane dotykaniem próbki itp. Część tych hipotez należało odrzucić już na podstawie wyników wspomnianej pracy Browna, pozostałe na podstawie badań tego uczonego, których rezultaty opublikował w 1829 r. Przeprowadził on między innymi sprytny eksperyment polegający na dodaniu do wody, w której zawieszone były drobne ziarenka, odrobiny oleju. Po wstrząśnięciu powstały kropelki wody otoczone cienką warstewką oleju. Spowodowało to drastyczne ograniczenie parowania, mimo to intensywność ruchów ziarenek nie zmalała. Niektóre kropelki zawierały tylko jedno ziarenko i również wtedy poruszało się ono w charakterystyczny sposób. Ani parowanie, ani wzajemne oddziaływanie cząsteczek zawiesiny nie mogły być zatem przyczyną tajemniczych ruchów. Nie bacząc na te rezultaty następne pokolenia fizyków wracały do wszystkich wspomnianych hipotez, by przy ich pomocy uzyskać rozwiązanie zagadki. Tymczasem zainteresowanie pracami Browna szybko zmalało i przez blisko trzydzieści następnych lat nic istotnego w tej sprawie się nie wydarzyło. Fizycy mieli poważniejsze problemy do rozwiązania. Tak przynajmniej uważali.
W ciągu tych trzydziestu lat nastąpił znaczący postęp w innych dziedzinach fizyki. Przede wszystkim w latach czterdziestych i pięćdziesiątych XIX w. sformułowano ostatecznie podstawowe prawa termodynamiki. Najpierw za sprawą R. Mayera, J. P. Joule'a i H. Helmholtza została sformułowana I zasada termodynamiki, która sprowadzała się do rozszerzenia znanego z mechaniki prawa zachowania energii na wszystkie procesy makroskopowe. Wkrótce potem R. Clausius i W. Thomson (lord Kelvin) inspirowani przez pracę Carnota zakończyli sukcesem zmagania z drugą zasadą termodynamiki. Stwierdzała ona niemożliwość skonstruowania tzw. perpetuum mobile II rodzaju, czyli urządzenia pobierającego ciepło z otoczenia i w całości zamieniającego je na pracę. Rozpoczęło się teraz pasmo sukcesów termodynamiki. Na podstawie jej zasad i przy użyciu niezbyt zaawansowanego aparatu matematycznego potrafiono opisać i zrozumieć ogromną ilość zjawisk przyrody. Nie mogło to pozostać bez wpływu na światopogląd ówczesnych fizyków. Termodynamika obok mechaniki stała się wzorcem doskonałości teorii fizycznej.
Przypomniano sobie wtedy o ruchach Browna - nie bez powodu. Nie trzeba było przeprowadzać zbyt subtelnego rozumowania, by stwierdzić, że zjawisko to trudno pogodzić z prawami termodynamiki. Przecież zgodnie z II zasadą izolowany układ fizyczny powinien po pewnym czasie osiągnąć stan równowagi termodynamicznej, co oznaczało, że ruchy cząsteczek zawiesiny powinny stopniowo zanikać. Przyjmując, że prawa termodynamiki odnoszą się do wszystkich zjawisk fizycznych, jedyną możliwością uniknięcia sprzeczności było wykazanie, iż przyczyną ruchów Browna są czynniki zewnętrzne. Tą drogą poszło wielu fizyków. Powrócono ponownie do hipotez wysuwanych w latach 1828-1829 i rozpoczęto szczegółowe badania. Prowadzono je przez blisko pięćdziesiąt lat nie osiągając pozytywnych rezultatów. Cantoni umieścił zawiesinę pomiędzy dwoma szkiełkami eliminując w ten sposób parowanie. Próbkę przechowywał przez rok. Po roku ruchy ziarenek były identyczne jak pierwszego dnia. Na zmianę intensywności ruchów Browna nie miały również wpływu: wyeliminowanie wstrząsów, umieszczenie próbki w kąpieli o stałej temperaturze, gotowanie zawiesiny przez godzinę, stosowanie światła o różnych barwach, ani zmiana jego natężenia w stosunku 1:1000. Ustalono jednak kilka ważnych faktów. Intensywność ruchów wzrastała wraz ze wzrostem temperatury, malała wraz ze wzrostem rozmiarów cząsteczek (przy średnicy większej niż 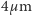 ruchy Browna były niedostrzegalne) i była tym mniejsza, im większa była lepkość cieczy.
ruchy Browna były niedostrzegalne) i była tym mniejsza, im większa była lepkość cieczy.
Jak już wspomnieliśmy na wstępie, począwszy od lat pięćdziesiątych XIX w. nastąpił intensywny rozwój teorii kinetyczno-molekularnej opartej na hipotezie o atomowej strukturze materii. Przy pomocy tej hipotezy i przy użyciu metod statystycznych można było wyjaśnić istotę wielu zjawisk fizycznych i uzyskać ich ilościowy opis. Przykładowo, ciśnienie gazu sprowadzono do wyniku zderzeń atomów czy molekuł gazu ze ściankami naczynia, temperaturę absolutną 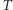 powiązano ze średnią energią kinetyczną
powiązano ze średnią energią kinetyczną 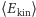 molekuły gazu
molekuły gazu 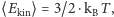 gdzie
gdzie 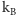 jest stałą Boltzmanna), wyprowadzono równanie stanu gazu doskonałego i równanie van der Waalsa, wyjaśniono zjawisko lepkości i przewodnictwa cieplnego wyliczając odpowiednie współczynniki transportu itp. Stosunkowo szybko zauważono (Wiener, Cantoni), że teoria kinetyczna dostarcza prostego wytłumaczenia ruchów Browna. Po prostu ruchy te są wynikiem zderzeń molekuł cieczy z ziarenkiem zawiesiny. Molekuły cieczy uderzając ziarenka z różnych stron powodują ich zygzakowaty ruch. Wydawałoby się, że zagadka została rozwiązana. Na pełny sukces trzeba było jednak jeszcze długo czekać.
jest stałą Boltzmanna), wyprowadzono równanie stanu gazu doskonałego i równanie van der Waalsa, wyjaśniono zjawisko lepkości i przewodnictwa cieplnego wyliczając odpowiednie współczynniki transportu itp. Stosunkowo szybko zauważono (Wiener, Cantoni), że teoria kinetyczna dostarcza prostego wytłumaczenia ruchów Browna. Po prostu ruchy te są wynikiem zderzeń molekuł cieczy z ziarenkiem zawiesiny. Molekuły cieczy uderzając ziarenka z różnych stron powodują ich zygzakowaty ruch. Wydawałoby się, że zagadka została rozwiązana. Na pełny sukces trzeba było jednak jeszcze długo czekać.
We wstępie stwierdziliśmy przecież, że większość fizyków XIX w. nie wierzyła w istnienie atomów. Postawa ta miała swoje przyczyny. Nauka osiągnęła w tym okresie ogromne sukcesy m.in. dzięki wyeliminowaniu z rozważań wielu niewidzialnych fluidów, takich jak cieplik czy flogiston. Przyczyniło się to do spopularyzowania stanowiska filozoficznego zwanego nominalizmem. Zgodnie z tym stanowiskiem zajmowanie się hipotetycznymi tworami, których nikt nigdy nie widział, a takimi były atomy, nie miało sensu. Używano wprawdzie pojęcia atomu, ale widziano w nim tylko słowo oznaczające pewien zbiór faktów (między innymi jeden z głównych reprezentantów nominalizmu W. Ostwald starał się napisać podręcznik chemii (1900 r.) bez użycia tego słowa). Wyjaśnienie ruchów Browna na podstawie teorii kinetyczno-molekularnej musiało zatem spotkać się z ostrą krytyką. Tak też się stało. Najpełniej krytykę tę sformułował Karl Nägeli w swojej pracy z 1879 r. Korzystając z dostępnych ówcześnie danych o przewidywanych rozmiarach atomów wyliczył przeciętną prędkość, jaką mogło uzyskać ziarenko zawiesiny na skutek zderzenia z jedną molekułą cieczy. Uzyskana prędkość była niezwykle mała; dla ziarenek o średnicy 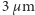 wynosiła ona tylko
wynosiła ona tylko 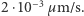 Aby cokolwiek można było zaobserwować pod mikroskopem, powinna ona być przynajmniej rzędu
Aby cokolwiek można było zaobserwować pod mikroskopem, powinna ona być przynajmniej rzędu 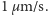 Co więcej, ziarenko jest bombardowane przez molekuły cieczy ze wszystkich stron z ogromną częstotliwością (średnio
Co więcej, ziarenko jest bombardowane przez molekuły cieczy ze wszystkich stron z ogromną częstotliwością (średnio 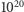 zderzeń na sekundę). Jeżeli nawet zostało poruszone w jedną stronę, to natychmiast na skutek uderzenia z drugiej strony zostanie zatrzymane. W rezultacie powinno stale pozostawać w jednym miejscu. Nieco później do tych zarzutów dołączono jeszcze jeden, bardzo poważny. Jeżeli przejdziemy nad uwagami Nägeli'ego do porządku dziennego, to i tak czeka nas przykra niespodzianka. Z punktu widzenia teorii kinetycznej na badane zawiesiny można spojrzeć jak na mieszaniny molekuł cieczy i bardzo dużych "molekuł", którymi są zawieszone ziarenka.
zderzeń na sekundę). Jeżeli nawet zostało poruszone w jedną stronę, to natychmiast na skutek uderzenia z drugiej strony zostanie zatrzymane. W rezultacie powinno stale pozostawać w jednym miejscu. Nieco później do tych zarzutów dołączono jeszcze jeden, bardzo poważny. Jeżeli przejdziemy nad uwagami Nägeli'ego do porządku dziennego, to i tak czeka nas przykra niespodzianka. Z punktu widzenia teorii kinetycznej na badane zawiesiny można spojrzeć jak na mieszaniny molekuł cieczy i bardzo dużych "molekuł", którymi są zawieszone ziarenka.

Zgodnie z przewidywaniami teorii kinetyczno-molekularnej w stanie równowagi termodynamicznej średnie energie różnych cząstek są sobie równe

W stanie o temperaturze 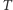 średnia energia kinetyczna każdej molekuły, a więc także i ziarenek, jest równa
średnia energia kinetyczna każdej molekuły, a więc także i ziarenek, jest równa 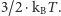 Możemy w związku z tym oszacować przewidywaną przez teorię kinetyczną prędkość pojedynczego ziarenka. W typowej sytuacji (
Możemy w związku z tym oszacować przewidywaną przez teorię kinetyczną prędkość pojedynczego ziarenka. W typowej sytuacji ( 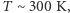 masa ziarenka
masa ziarenka 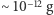 ) wynosi ona około
) wynosi ona około 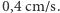 Tymczasem z pomiarów otrzymywano wartość około
Tymczasem z pomiarów otrzymywano wartość około 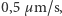 czyli prawie 10 tysięcy razy mniejszą! Ta niezgodność zbiła z tropu wielu fizyków. Jak zatem rozwikłano zagadkę ruchów Browna? O tym w następnym numerze Delty.
czyli prawie 10 tysięcy razy mniejszą! Ta niezgodność zbiła z tropu wielu fizyków. Jak zatem rozwikłano zagadkę ruchów Browna? O tym w następnym numerze Delty.