O wiązaniach wodorowych
Niektóre pierwiastki, takie jak fluor czy tlen – czyli w języku chemii te najbardziej elektroujemne – mają zdolność tworzenia specyficznego rodzaju wiązania jonowego, nazywanego wiązaniem wodorowym. Wiązania wodorowe są słabsze od wiązań kowalencyjnych i od zwykłych wiązań jonowych, a silniejsze niż oddziaływania van der Waalsa (choć siła tych ostatnich na ogół wzrasta wraz ze wzrostem liczby elektronów w cząsteczce)...
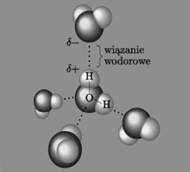
Schemat wiązań wodorowych między cząsteczkami wody (wg Wikipedii).
Klasyczne wiązanie wodorowe tworzy się, gdy atom wodoru jest kowalencyjnie związany z atomem silnie elektroujemnym. W obecności innej takiej samej cząsteczki atom wodoru jest przez nią nieco odciągany od swego atomowego partnera, co osłabia wewnętrzne wiązanie w cząsteczce, ale powoduje utworzenie słabego wiązania elektrostatycznego dwóch cząsteczek.
Zbadajmy dokładniej niektóre własności wiązań wodorowych w oparciu
o dane liczbowe łatwe do znalezienia w różnego rodzaju tablicach fizycznych.
Tabelka na marginesie przedstawia wartości ciepeł sublimacji trzech
par substancji izoelektronowych, tj. każda z cząsteczek danej pary ma
tyle samo elektronów (choć liczba ta jest różna dla różnych par).
Wiedząc, że we wszystkich przypadkach pomiędzy cząsteczkami występuje
oddziaływanie van der Waalsa, a tylko cząsteczki H
 O tworzą
wiązania wodorowe, możemy oszacować wartość ciepła sublimacji
hipotetycznej postaci lodu, w której cząsteczki związane są jedynie siłami
van der Waalsa, a następnie wyznaczyć energię wiązania wodorowego
w lodzie. Stosunek ciepeł sublimacji dla drugiej i trzeciej pary ma wartość
około
O tworzą
wiązania wodorowe, możemy oszacować wartość ciepła sublimacji
hipotetycznej postaci lodu, w której cząsteczki związane są jedynie siłami
van der Waalsa, a następnie wyznaczyć energię wiązania wodorowego
w lodzie. Stosunek ciepeł sublimacji dla drugiej i trzeciej pary ma wartość
około
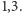 Możemy więc przyjąć w przybliżeniu, że taki sam
byłby on dla pierwszej pary, gdyby dla H
Możemy więc przyjąć w przybliżeniu, że taki sam
byłby on dla pierwszej pary, gdyby dla H
 O nie istniały wiązania
wodorowe. Wtedy ciepło sublimacji wody byłoby równe nie 51 kJ/mol, lecz
O nie istniały wiązania
wodorowe. Wtedy ciepło sublimacji wody byłoby równe nie 51 kJ/mol, lecz
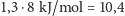 kJ/mol. Zważywszy na fakt, że cząsteczka wody ma
dwa protony, stwierdzamy, iż energia pojedynczego wiązania wodorowego jest
połową różnicy rzeczywistej i obliczonej wyżej wartości ciepła sublimacji,
zatem otrzymujemy energię wiązania wodorowego w wodzie równą
około 20 kJ/mol.
kJ/mol. Zważywszy na fakt, że cząsteczka wody ma
dwa protony, stwierdzamy, iż energia pojedynczego wiązania wodorowego jest
połową różnicy rzeczywistej i obliczonej wyżej wartości ciepła sublimacji,
zatem otrzymujemy energię wiązania wodorowego w wodzie równą
około 20 kJ/mol.
Co się dzieje z wiązaniami wodorowymi, kiedy lód topnieje? Ciepło topnienia
lodu wynosi
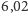 kJ/mol. Ciepło topnienia metanu jest znacznie
niższe i wynosi
kJ/mol. Ciepło topnienia metanu jest znacznie
niższe i wynosi
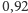 kJ/mol. Na podstawie tych liczb możemy
oszacować, jaka część wiązań wodorowych w lodzie ulega rozerwaniu
w wyniku topnienia. Energię potrzebną do rozerwania wiązań wodorowych
w lodzie podczas topnienia możemy wyznaczyć jako różnicę między
ciepłami topnienia lodu i metanu; wynosi ona więc około
kJ/mol. Na podstawie tych liczb możemy
oszacować, jaka część wiązań wodorowych w lodzie ulega rozerwaniu
w wyniku topnienia. Energię potrzebną do rozerwania wiązań wodorowych
w lodzie podczas topnienia możemy wyznaczyć jako różnicę między
ciepłami topnienia lodu i metanu; wynosi ona więc około
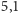 kJ/mol.
Obliczyliśmy wcześniej, że całkowita energia wiązań wodorowych wynosi
około 40 kJ/mol, a zatem rozpadowi ulega jedynie około 1/8 wszystkich
wiązań wodorowych.
kJ/mol.
Obliczyliśmy wcześniej, że całkowita energia wiązań wodorowych wynosi
około 40 kJ/mol, a zatem rozpadowi ulega jedynie około 1/8 wszystkich
wiązań wodorowych.

Okazuje się, że jest to oszacowanie mocno zawyżone. Z doświadczenia wynika, iż zerwaniu ulega znacznie mniejsza liczba wiązań wodorowych, co oznacza, że nasze wyniki należy interpretować jako miarę zmiany energii wiązań wodorowych związaną z ich deformacją. Używając pojęć mechanicznych, moglibyśmy wyobrażać sobie, że wiązania te są rozciągane i skręcane.
Wiązania wodorowe są odpowiedzialne, między innymi, za anomalną
rozszerzalność wody. Jak zobaczyliśmy, topnienie lodu niszczy je
tylko w niewielkim stopniu, dlatego objętość wody nie różni się
znacząco od objętości lodu, z którego powstała. W odpowiednio niskich
temperaturach (od
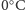 do
do
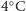 ) występowanie wiązań
wodorowych znacząco wpływa na odległości i wzajemne ustawienie cząsteczek
wody. Dzięki temu w opisywanym zakresie temperatur gęstość wody rośnie
ze wzrostem temperatury.
) występowanie wiązań
wodorowych znacząco wpływa na odległości i wzajemne ustawienie cząsteczek
wody. Dzięki temu w opisywanym zakresie temperatur gęstość wody rośnie
ze wzrostem temperatury.
Warto tu przy okazji wspomnieć o szarlatanerii nazywanej homeopatią. Środki (bo nie są to żadne leki) homeopatyczne to wodne roztwory (czego – to bez większego znaczenia) o tak silnym stopniu rozcieńczenia, że prawdopodobieństwo napotkania cząsteczki substancji rzekomo czynnej jest mniejsze od prawdopodobieństwa trafienia szóstki w lotto. Jak zatem coś takiego mogłoby leczyć? Niesławnej pamięci immunolog francuski, Jacques Benveniste, twierdził, że udowodnił istnienie zjawiska pamięci wody. Otóż substancja rozpuszczana miałaby pozostawiać po sobie informację zawartą w drganiach cząsteczek lub w ich strukturze. Teoria ta została wielokrotnie sfalsyfikowana doświadczalnie.
Mimo to istnieją żerujące na ludzkiej naiwności firmy produkujące i sprzedające urządzenia, które rzekomo zmieniają strukturę wody. „Żywa woda” – jak nazywają wynik działania tych maszynek – różni się od tej złej, czyli „martwej”, tym, że ma strukturę heksagonalną. Z tego, co powiedzieliśmy powyżej, wiemy, że taka struktura jest w wodzie obecna zawsze, przynajmniej w niezbyt wysokich temperaturach. Odważny Czytelnik Delty, ryzykując sądowy pozew, bez trudu może udowodnić „specjaliście” od wody heksagonalnej jego oszustwo. Gdyby w „złej” wodzie poddanej działaniu urządzenia uzdatniającego powstawała heksagonalna struktura, powinna wzrosnąć objętość wody. A to jest akurat bardzo łatwe do sprawdzenia.