Aktualności (nie tylko) fizyczne
Fotoliza, anataz i rutyl oraz na co komu jak najlepsza rdza?
Fotosynteza jest czymś naprawdę fascynującym. Nas, czyli zwierząt, bez niej nie byłoby. Nie mielibyśmy ani czym oddychać, ani co jeść (nawet jeżeli ktoś nie czuje się wegetarianinem). Nie byłoby, co prawda, korków (nawet gdyby samochody mogły jeździć rzeczywiście same), bo przecież węgiel kamienny i węglowodory są (prawie wyłącznie) pozostałością milionów lat fotosyntezy właśnie.

Puszczanie z dymem tego całego zapasu nie wygląda na najrozsądniejsze. Dopóki jednak będzie wyglądało na najtańsze, to z niego (puszczania znaczy) nie zrezygnujemy. A żeby wyglądać przestało, to możliwości są, zasadniczo, dwie. Albo ten łatwopalny materiał zacznie się kończyć, albo coś wymyślimy. Moim zdaniem samo to drugie nie nastąpi, co nie znaczy, że nie da się na nim, czyli na wymyślaniu, skorzystać.
Fotosynteza zachodzi (w dużym uproszczeniu) za pomocą dwóch podprocesów. W pierwszym odbywa się fotoliza wody. Pochłonięta energia promieniowania pojawia się w postaci elektronu oderwanego od wody, która rozpada się na obojętny tlen oraz dodatnio naładowany wodór. Tlen jest produktem ubocznym, natomiast elektrony i protony są transportowane różnymi drogami do miejsca, w którym na końcu powstaje z nich oraz ditlenku węgla cukier (oraz połowa wody, od której fotolizy cały proces się rozpoczął), a także odtwarzane są wszystkie katalizatory.
Cukier to sposób, jaki Natura wymyśliła na magazynowanie wodoru. Inaczej mówiąc, w procesie fotosyntezy energia świetlna służy do odrywania wodoru od wody, który dzięki reszcie energii jest magazynowany. Dokładnie o to samo chodzi w procesie sztucznej fotolizy (nazywanej też sztuczną fotosyntezą, nawet jeżeli jedynym produktem tej syntezy jest cząsteczkowy wodór, oprócz, jak w naturalnej fotosyntezie, odpadowego tlenu).
W maju ukazała się praca [1]. Pracujący w Kalifornii naukowcy (o dalekowschodnio brzmiących nazwiskach) opisują w niej nanostrukturę, w której zachodzi fotoliza wody z efektywnością porównywalną do naturalnej fotosyntezy. Autorzy wytworzyli nano-lasek z krzemowymi pniami oraz gałązkami z ditlenku tytanu, który jest jednym z ulubionych materiałów w tej dziedzinie. Gałązki wychwytują promieniowanie ultrafioletowe, generując parę elektron-dziura. Ta ostatnia redukuje tlen do postaci cząsteczkowej, pozostawiając jon wodorowy. Natomiast pień pochłania promieniowanie widzialne, co też prowadzi do powstania pary elektron-dziura, ale tym razem to elektron neutralizuje jony wodorowe, a dziura wędruje na spotkanie z elektronem uwolnionym w poprzednio opisanym procesie. W ten sposób obwód fotolizy się zamyka. Do oderwania pojedynczego atomu wodoru od wody oraz jego zneutralizowania potrzeba tylko dwóch fotonów.
Jeżeli chodzi o sam ditlenek tytanu
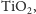 to występuje on dość
powszechnie (największym dostawcą jest Australia). Znane są trzy odmiany
alotropowe: rutyl, anataz oraz brukit. Od czterdziestu lat wiadomo, że związek
ten umożliwia fotolizę wody. Dzięki temu znajduje coraz więcej zastosowań.
Choć i tak najpowszechniej jest używany do produkcji bieli tytanowej,
stosowanej wszędzie, gdzie potrzebna jest jaskrawa biała barwa, oraz do
otrzymywania metalicznego tytanu. Natomiast ze względu na silne pochłanianie
promieniowania ultrafioletowego używa się go do produkcji filtrów
przeciwsłonecznych, a własności fotojonizacyjne wykorzystywane są do
wykonywania samoczyszczących się powłok.
to występuje on dość
powszechnie (największym dostawcą jest Australia). Znane są trzy odmiany
alotropowe: rutyl, anataz oraz brukit. Od czterdziestu lat wiadomo, że związek
ten umożliwia fotolizę wody. Dzięki temu znajduje coraz więcej zastosowań.
Choć i tak najpowszechniej jest używany do produkcji bieli tytanowej,
stosowanej wszędzie, gdzie potrzebna jest jaskrawa biała barwa, oraz do
otrzymywania metalicznego tytanu. Natomiast ze względu na silne pochłanianie
promieniowania ultrafioletowego używa się go do produkcji filtrów
przeciwsłonecznych, a własności fotojonizacyjne wykorzystywane są do
wykonywania samoczyszczących się powłok.
Jeżeli chodzi o fotolizę, to z dwóch najpowszechniej występujących odmian skuteczniejszy jest anataz, a mniej skuteczny rutyl. Jednak jeszcze lepiej działa ich mieszanka. Choć na temat tego związku chemicznego ukazuje się kilka tysięcy artykułów naukowych rocznie, to ta własność pozostawała zagadką. Kilkanaście lat temu (1996) wydawało się, że została ona wyjaśniona poprzez stwierdzenie niewielkiego przesunięcia poziomu (energii) pasm elektronowych tych odmian. Miałoby ono powodować przepływ elektronów z pasma przewodnictwa z anatazy do rutylu, a dziur z pasma walencyjnego w odwrotnym kierunku. Ostatnio jednak coraz więcej pojawiało się pomiarów sugerujących, że jest odwrotnie. W sierpniu ukazała się praca [2] ostatecznie (?) to potwierdzająca, której autorzy (artykuł podpisało piętnastu, co stanowi bardzo dużą grupę w tej dziedzinie) przeprowadzili zaawansowane symulacje zgadzające się z pomiarami. Wygląda na to, że „podręczniki trzeba będzie napisać na nowo”.
W poszukiwaniu jak najtańszych i jak najefektywniejszych katalizatorów fotolizy nie można pominąć rdzy, czyli tlenków żelaza. Nie ma w tym nic dziwnego. Rdza zżera stare żelastwo szczególnie skutecznie przy udziale wody, między innymi dzięki temu, że ulega ona (woda) dysocjacji.
Związkiem, który teoretycznie mógłby być rewelacyjny, a praktycznie
również jest bardzo wydajny, jest hematyt
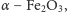 czyli jeden ze
składników rdzy. Żeby fotoelektroda dobrze działała, należy ją odpowiednio
nano-spreparować. W lipcu ukazała się praca [3], w której autorzy donoszą
o rozpoznaniu wśród spreparowanych nano-porowatych struktur hematytu
fragmentów o wydajności bliskiej przewidywaniom teoretycznym.
W dodatkowych materiałach propagandowych napisano, że zanurzona
w wodzie elektroda pokrywa się pęcherzykami gazu natychmiast po wystawieniu
na promieniowanie słoneczne.
czyli jeden ze
składników rdzy. Żeby fotoelektroda dobrze działała, należy ją odpowiednio
nano-spreparować. W lipcu ukazała się praca [3], w której autorzy donoszą
o rozpoznaniu wśród spreparowanych nano-porowatych struktur hematytu
fragmentów o wydajności bliskiej przewidywaniom teoretycznym.
W dodatkowych materiałach propagandowych napisano, że zanurzona
w wodzie elektroda pokrywa się pęcherzykami gazu natychmiast po wystawieniu
na promieniowanie słoneczne.
Może to będzie nasza specjalność? Na tylu dachach mamy już przecież zapuszczoną podobną strukturę.