Krzem okiem chemika
Krzem jest pierwiastkiem chemicznym o symbolu
 (łac. Silicium),
położonym w 14. grupie układu okresowego (węglowce) i w 3. okresie. Jego
liczba atomowa wynosi 14, co oznacza, że atom tego pierwiastka zawiera
14 protonów i 14 elektronów. Przynależność tego pierwiastka do grupy
węglowców wskazuje, że powinien on mieć własności chemiczne podobne
do węgla.
(łac. Silicium),
położonym w 14. grupie układu okresowego (węglowce) i w 3. okresie. Jego
liczba atomowa wynosi 14, co oznacza, że atom tego pierwiastka zawiera
14 protonów i 14 elektronów. Przynależność tego pierwiastka do grupy
węglowców wskazuje, że powinien on mieć własności chemiczne podobne
do węgla.
Krzem występuje w postaci odmiany krystalograficznej, której odpowiada sieć
przestrzenna typu diamentu. Każdy atom krzemu połączony jest z czterema
innymi atomami, tworząc trójwymiarową polimeryczną strukturę. Podstawowy
układ tej struktury jest czworościanem foremnym, w którym wszystkie
wierzchołki są obsadzone atomami krzemu i znajdują się w jednakowej
odległości od atomu krzemu, zajmującego środek tego czworościanu.
Stopienie krzemu wymaga rozerwania silnych wiązań działających we
wszystkich kierunkach, czego wynikiem jest wysoka temperatura topnienia
krzemu
 Kryształy krzemu mają ciemnoszarą barwę, wykazują
one znaczną twardość, ale są bardzo kruche. W temperaturze pokojowej
krzem jest substancją mało aktywną chemicznie, gdyż jego powierzchnia
pokryta jest cienką warstwą tlenku.
Kryształy krzemu mają ciemnoszarą barwę, wykazują
one znaczną twardość, ale są bardzo kruche. W temperaturze pokojowej
krzem jest substancją mało aktywną chemicznie, gdyż jego powierzchnia
pokryta jest cienką warstwą tlenku.
Położenie krzemu w układzie okresowym jednoznacznie definiuje rozkład jego
elektronów w atomie. Ma on konfigurację elektronów walencyjnych
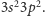 Oznacza to, że ma cztery elektrony na zewnętrznej powłoce i dlatego może on
tworzyć cztery wiązania, których kąty wynoszą około
Oznacza to, że ma cztery elektrony na zewnętrznej powłoce i dlatego może on
tworzyć cztery wiązania, których kąty wynoszą około
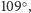 co jest
charakterystyczne dla układów tetraedrycznych (czworościanów foremnych).
Elektroujemność (tendencja do przyciągania elektronów) krzemu
wynosi
co jest
charakterystyczne dla układów tetraedrycznych (czworościanów foremnych).
Elektroujemność (tendencja do przyciągania elektronów) krzemu
wynosi
 a zatem pierwiastek ten chętniej oddaje, niż przyjmuje
elektrony w związkach. Wysokie wartości energii jonizacji (oderwania
elektronów) świadczą o tym, że krzem nie występuje w postaci prostych
jonów.
a zatem pierwiastek ten chętniej oddaje, niż przyjmuje
elektrony w związkach. Wysokie wartości energii jonizacji (oderwania
elektronów) świadczą o tym, że krzem nie występuje w postaci prostych
jonów.
Czysty krzem otrzymuje się z krzemionki
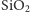 w reakcji z magnezem,
glinem lub węglem, zgodnie ze wzorem
w reakcji z magnezem,
glinem lub węglem, zgodnie ze wzorem

Tak otrzymany krzem jest dodatkowo oczyszczany w reakcjach z kwasem solnym i kwasem fluorowodorowym oraz poprzez topnienie strefowe. „Ultraczysty” krzem jest wykorzystywany w elektronice jako półprzewodnik (patrz strona 16).
Czysty krzem łatwo rozpuszcza się nawet w rozcieńczonych roztworach mocnych zasad, tworząc krzemiany zgodnie ze schematem

Powstały w powyższej reakcji metakrzemian sodowy jest solą rozpuszczalną
w wodzie i często jest składnikiem detergentów. Jony
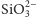 przywierają
do cząstek brudu, nadając im ładunek ujemny. Zapobiega to łączeniu się cząstek
brudu w większe nierozpuszczalne agregaty, jak również przyczepianiu się
brudu do powierzchni tkanin.
przywierają
do cząstek brudu, nadając im ładunek ujemny. Zapobiega to łączeniu się cząstek
brudu w większe nierozpuszczalne agregaty, jak również przyczepianiu się
brudu do powierzchni tkanin.

Rys. 1
Kolejnym niezwykle ważnym związkiem jest dwutlenek krzemu, który
podobnie jak dwutlenek węgla ma charakter kwasowy. Jednak, mimo że oba
pierwiastki leżą w tej samej grupie układu okresowego,
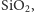 w przeciwieństwie do
w przeciwieństwie do
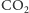 nie rozpuszcza się w wodzie. Sole kwasu
krzemowego otrzymuje się poprzez rozpuszczenie dwutlenku krzemu
w roztworach mocnych zasad, np.
nie rozpuszcza się w wodzie. Sole kwasu
krzemowego otrzymuje się poprzez rozpuszczenie dwutlenku krzemu
w roztworach mocnych zasad, np.

Krzemiany należą do ważnych związków nieorganicznych krzemu. W stanie stałym są to układy tetraedryczne, w których atom krzemu znajduje się w środku, a cztery atomy tlenu rozmieszczone są w narożach (Rys. 1). Różnice między poszczególnymi krzemianami wynikają z wypadkowego ładunku każdego tetraedru, liczby uwspólnionych z innymi tetraedrami atomów tlenu, a także rozmieszczenia tetraedrów względem siebie.
Krzemiany sodowe ulegają w wodzie reakcji hydrolizy, w wyniku czego powstaje
słaby kwas ortokrzemowy
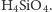 Kwas ten wykazuje tendencję do
odszczepiania cząsteczki wody i kondensowania z utworzeniem kwasów
wielokrzemowych. Kwasy te mogą mieć strukturę prostych lub rozgałęzionych
łańcuchów
Kwas ten wykazuje tendencję do
odszczepiania cząsteczki wody i kondensowania z utworzeniem kwasów
wielokrzemowych. Kwasy te mogą mieć strukturę prostych lub rozgałęzionych
łańcuchów
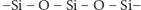 . Szybkość kondensacji zależy
od pH roztworu i jest najwyższa w pH 7 (roztwór obojętny). Kwasy
krzemowe słabo rozpuszczają się w wodzie, tworzą roztwory koloidalne lub
galaretowate osady, przy czym cały roztwór może zakrzepnąć w jednolity
żel. Mieszaninie kwasów krzemowych przypisuje się ogólny wzór
. Szybkość kondensacji zależy
od pH roztworu i jest najwyższa w pH 7 (roztwór obojętny). Kwasy
krzemowe słabo rozpuszczają się w wodzie, tworzą roztwory koloidalne lub
galaretowate osady, przy czym cały roztwór może zakrzepnąć w jednolity
żel. Mieszaninie kwasów krzemowych przypisuje się ogólny wzór
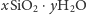 . Stosunek ilościowy
. Stosunek ilościowy
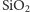 do wody jest zmienny,
zależny od warunków otrzymania żelu. Suszenie żelu prowadzi do
produktu o bardzo rozwiniętej powierzchni i doskonałych własnościach
sorpcyjnych.
do wody jest zmienny,
zależny od warunków otrzymania żelu. Suszenie żelu prowadzi do
produktu o bardzo rozwiniętej powierzchni i doskonałych własnościach
sorpcyjnych.

Zdjęcie żelu krzemionkowego otrzymane za pomocą skaningowego mikroskopu elektronowego.
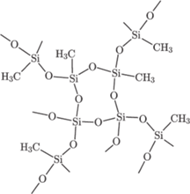
Rys. 2 Fragment usieciowanego silikonu powstałego z metylosilanolu.
Wysuszony osad uwodnionej krzemionki (żel krzemionkowy) w zetknięciu z roztworami wodnymi pochłania z nich różne substancje, ale również sam częściowo rozpuszcza się w wodzie. Ta własność wykorzystywana jest do stosowania żelu jako środka chroniącego przed wilgocią. Silnie rozwinięta powierzchnia żelu krzemionkowego pozwala na adsorbowanie na niej wielu substancji. Zatrzymane w żelu związki chemiczne mogą być z niego wymyte i żel taki nadaje się do ponownego użycia.
Krzem, podobnie jak węgiel, tworzy bardzo wiele związków łańcuchowych.
Porównanie wartości energii wiązania
 (368 kJ/mol)
i
(368 kJ/mol)
i
 (176 kcal/mol) wskazuje, że trwałe łańcuchy są tworzone
przede wszystkim przez atomy tlenu i krzemu ułożone na przemian
(176 kcal/mol) wskazuje, że trwałe łańcuchy są tworzone
przede wszystkim przez atomy tlenu i krzemu ułożone na przemian
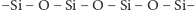 . Z tego powodu większość związków
chemicznych krzemu zawiera tlen.
. Z tego powodu większość związków
chemicznych krzemu zawiera tlen.
Krzem z wodorem tworzy silany (krzemowodory) typu
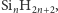 ale, jak
dotąd, udało się otrzymać tylko nierozgałęzione łańcuchy o 6 atomach
krzemu. Silany łatwo ulegają reakcji hydrolizy z wydzieleniem wodoru
ale, jak
dotąd, udało się otrzymać tylko nierozgałęzione łańcuchy o 6 atomach
krzemu. Silany łatwo ulegają reakcji hydrolizy z wydzieleniem wodoru

Do znacznie trwalszych związków krzemu należą silikony, czyli organiczne
związki krzemu. Powstają one z chlorosilanów (SiCl
 ), w których jeden,
dwa lub trzy atomy chloru zostały zastąpione przez łańcuchy węglowodorowe
zgodnie ze schematem reakcji
), w których jeden,
dwa lub trzy atomy chloru zostały zastąpione przez łańcuchy węglowodorowe
zgodnie ze schematem reakcji

Tak utworzone związki ulegają w wodzie hydrolizie

W wyniku kondensacji otrzymanych metylosilanoli
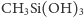 powstają polimery – układy łańcuchowe, które mogą być dodatkowo
połączone (usieciowane) wiązaniami poprzecznymi
powstają polimery – układy łańcuchowe, które mogą być dodatkowo
połączone (usieciowane) wiązaniami poprzecznymi
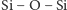 .
Przykładowy fragment takiego polimeru przedstawiony jest na rysunku 2.
.
Przykładowy fragment takiego polimeru przedstawiony jest na rysunku 2.
Silikony znalazły szerokie zastosowanie zarówno w przemyśle, jak
i w gospodarstwie domowym. W zależności od warunków otrzymywania
mogą występować w postaci olejów, żywic lub elastomerów. Wykazują one
niezwykle cenne własności praktyczne, takie jak odporność chemiczna
i temperaturowa. Większość z nich nie ulega rozkładowi w temperaturach
poniżej
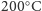 . Znikomo mała prężność pary oraz niezmieniająca się
lepkość w szerokim zakresie temperatur powoduje, że silikony mogą być
wykorzystywane jako smary w urządzeniach pracujących w podwyższonej
temperaturze. Silikony mają własności silnie hydrofobowe (odpychające wodę)
i dlatego są wykorzystywane do impregnowania tkanin. Atomy tlenu przywierają
do tkaniny, a hydrofobowe grupy metylowe sterczą z powierzchni tkaniny na
zewnątrz jak mikroskopijne odwrócone parasole. Z tych samych powodów
silikony są bierne biologicznie i nie ulegają zmianom pod wpływem płynów
ustrojowych. Dlatego właśnie mogą być wykorzystywane w medycynie jako
np. protezy stawów.
. Znikomo mała prężność pary oraz niezmieniająca się
lepkość w szerokim zakresie temperatur powoduje, że silikony mogą być
wykorzystywane jako smary w urządzeniach pracujących w podwyższonej
temperaturze. Silikony mają własności silnie hydrofobowe (odpychające wodę)
i dlatego są wykorzystywane do impregnowania tkanin. Atomy tlenu przywierają
do tkaniny, a hydrofobowe grupy metylowe sterczą z powierzchni tkaniny na
zewnątrz jak mikroskopijne odwrócone parasole. Z tych samych powodów
silikony są bierne biologicznie i nie ulegają zmianom pod wpływem płynów
ustrojowych. Dlatego właśnie mogą być wykorzystywane w medycynie jako
np. protezy stawów.
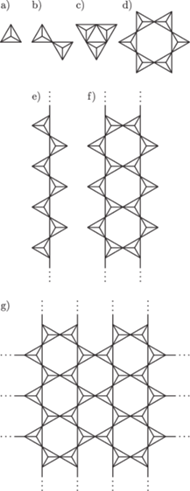
Rys. 3 Struktury niektórych anionów występujących w krystalicznych krzemianach:
a)
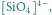 b)
b)
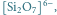
c)
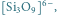 d)
d)
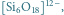
e)
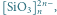 f)
f)
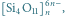
g)
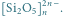
W stanie naturalnym krzem występuje w postaci krzemionki
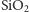 i minerałów krzemianowych, stanowiąc materiał, z którego zbudowana jest
przeważająca część skorupy ziemskiej. Pierwiastek ten zajmuje drugie miejsce
(
i minerałów krzemianowych, stanowiąc materiał, z którego zbudowana jest
przeważająca część skorupy ziemskiej. Pierwiastek ten zajmuje drugie miejsce
(
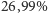 wagowych) pod względem obecności w przyrodzie. Krzemiany
i glinokrzemiany stanowią grupę najbardziej rozpowszechnionych minerałów
w przyrodzie. Głównym ich elementem są czworościany
wagowych) pod względem obecności w przyrodzie. Krzemiany
i glinokrzemiany stanowią grupę najbardziej rozpowszechnionych minerałów
w przyrodzie. Głównym ich elementem są czworościany
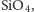 które
istnieją zawsze niezależnie od wzoru chemicznego krzemianu. Badania
rentgenowskie krzemianów wskazały, że duże jony tlenu
które
istnieją zawsze niezależnie od wzoru chemicznego krzemianu. Badania
rentgenowskie krzemianów wskazały, że duże jony tlenu
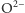 (promień
jonowy
(promień
jonowy
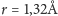 ) otaczają małe jony krzemu
) otaczają małe jony krzemu
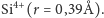 Stosunek promieni jonowych wskazuje na liczbę koordynacyjną 4, czyli, że
każdy jon krzemu otoczony jest przez cztery jony tlenu. Składnikami
budującymi sieć krystalograficzną są czterowartościowe aniony
Stosunek promieni jonowych wskazuje na liczbę koordynacyjną 4, czyli, że
każdy jon krzemu otoczony jest przez cztery jony tlenu. Składnikami
budującymi sieć krystalograficzną są czterowartościowe aniony
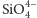 oraz kationy np. magnezu, żelaza, cynku, cyrkonu, wapnia, znajdujące się
w sieci między czworościanami. Struktury anionów, odpowiadających
niektórym grupom krzemianów występujących w przyrodzie, przedstawia
rysunek 3. Różnicom struktur wewnętrznych krzemianów odpowiadają
materiały o różnych właściwościach, od kamieni szlachetnych do włókien
(azbest). W zależności od wzajemnego położenia czworościanów
oraz kationy np. magnezu, żelaza, cynku, cyrkonu, wapnia, znajdujące się
w sieci między czworościanami. Struktury anionów, odpowiadających
niektórym grupom krzemianów występujących w przyrodzie, przedstawia
rysunek 3. Różnicom struktur wewnętrznych krzemianów odpowiadają
materiały o różnych właściwościach, od kamieni szlachetnych do włókien
(azbest). W zależności od wzajemnego położenia czworościanów
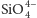 rozróżnia się
rozróżnia się
- krzemiany wyspowe, czyli takie, w których każdy jon tlenu
należy tylko do jednego jonu krzemu – np. oliwin
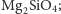
- krzemiany grupowe, w których
czworościany łączą się narożami poprzez wspólny atom tlenu –
np.
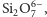 tworząc układy łańcuchowe – np.
tworząc układy łańcuchowe – np.
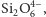 lub pierścieniowe –
lub pierścieniowe –
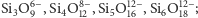 przykładami takich minerałów mogą
być wolastonit
przykładami takich minerałów mogą
być wolastonit
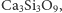 beryl
beryl
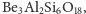 azbest
azbest
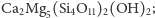
- krzemiany warstwowe,
w których utworzone warstwy – np.
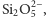 powstają
w wyniku tego, że każdy z trzech atomów tlenu każdego
czworościanu związany jest jednocześnie z dwoma atomami
krzemu sąsiednich tetraedrów, a czwarty atom tlenu połączony
jest tylko z jednym atomem krzemu; takimi krzemianami są np.
mika i talk
powstają
w wyniku tego, że każdy z trzech atomów tlenu każdego
czworościanu związany jest jednocześnie z dwoma atomami
krzemu sąsiednich tetraedrów, a czwarty atom tlenu połączony
jest tylko z jednym atomem krzemu; takimi krzemianami są np.
mika i talk
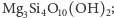
- krzemiany przestrzenne (szkieletowe), w których wszystkie atomy
tlenu każdego czworościanu należą jednocześnie do dwóch
czworościanów; czworościany stykające się narożami tworzą
trójwymiarową
sieć koordynacyjną o stosunku
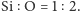 Tego rodzaju
struktury mają wszystkie odmiany kwarcu.
Tego rodzaju
struktury mają wszystkie odmiany kwarcu.
Naturalne krzemiany stanowią cenne surowce dla przemysłu szklarskiego, ceramicznego i cementowego, a także wykorzystywane są jako kamienie jubilerskie.
Krzem widziany okiem chemika to niezwykle ciekawy pierwiastek. Jego
zdolność do tworzenia długich łańcuchów
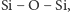 które można
stosunkowo łatwo modyfikować, jest coraz częściej wykorzystywana do
tworzenia nowych materiałów o unikalnych własnościach chemicznych
i mechanicznych.
które można
stosunkowo łatwo modyfikować, jest coraz częściej wykorzystywana do
tworzenia nowych materiałów o unikalnych własnościach chemicznych
i mechanicznych.
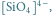 b)
b)
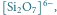
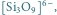 d)
d)
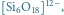
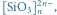 f)
f)