Wiązanie azotu – od zbrojenia do żywienia
Azot to pierwiastek będący jednym z podstawowych elementów budowy wszystkich żywych organizmów. Bez azotu nie istniałyby dwa kluczowe elementy skomplikowanego procesu życia: DNA, odpowiedzialne za przechowywanie i przenoszenie informacji genetycznej, oraz białka, będące mikroskopijnymi komórkowymi maszynami. Człowiek, podobnie jak inne zwierzęta, przyswaja azot głównie związany w postaci białek. Trawienie białek powoduje uwalnianie ich składników budulcowych, aminokwasów, z których każdy zawiera przynajmniej jeden atom azotu...
Aminokwasy mogą być przez organizm powtórnie wykorzystane, bądź zostać rozłożone na jeszcze mniejsze części. Zapotrzebowanie organizmów żywych na azot jest stabilne, więc przy odpowiedniej diecie pierwiastka tego nie brakuje. Z odzyskiwaniem i przetwarzaniem przydatnych substancji natura radzi sobie doskonale. Skąd jednak związki azotu może do swoich celów pozyskiwać człowiek? Zapotrzebowanie na nie nie jest tak stałe i przewidywalne, jak na substancje odżywcze w ewoluującym od milionów lat organizmie; jedno wydarzenie historyczne lub odkrycie naukowe może gwałtownie zwiększyć popyt na umiarkowanie dotychczas interesującą substancję.
Historycznym przykładem wzrostu zapotrzebowania na związki azotu jest wynalezienie i rozwój broni palnej. W przeciwieństwie do broni białej, broń palna wymaga użycia materiału wysokoenergetycznego, na przykład czarnego prochu, którego jednym z głównych składników jest saletra potasowa, inaczej azotan(V) potasu - sól kwasu azotowego(V). Kwas azotowy(V) jest z kolei używany przy produkcji bardziej współczesnych materiałów wysokoenergetycznych: nitrocelulozy, nitrogliceryny czy trotylu. Związki azotu, w tym sole kwasu azotowego oraz amoniaku, mają jednak drugie, zupełnie odmienne oblicze - są podstawowymi składnikami nawozów mineralnych, preparatów dostarczających roślinom niezbędne składniki odżywcze, powszechnie używanych do zwiększenia wydajności upraw rolnych.
Czym się różni azot od... azotu?
Azotany występują naturalnie w skorupie ziemskiej w postaci minerałów. Problem w tym, że ich rozmieszczenie na świecie nie jest równomierne, co może zostałoby im wybaczone, gdyby nie fakt, że zdecydowały się występować z dala od ośrodków przemysłowych, które chciałyby je wykorzystać. W dodatku minerały nie są surowcami odnawialnymi; prędzej czy później ich złoża będą wyczerpane, a procesów geologicznych, które doprowadziły do ich powstania, nie da się przyspieszyć. Sprowadzanie potrzebnych minerałów z odległych i nielicznych miejsc na świecie wiąże się z dodatkowym, praktycznym problemem: możliwością dyktowania cen, bądź wstrzymaniem dostaw pod presją sił politycznych. W takiej sytuacji znalazło się Cesarstwo Niemieckie na przełomie XIX i XX wieku. Wobec ograniczonego dostępu do światowych złóż saletry, niezbędnej do wytwarzania amunicji oraz nawożenia upraw rolnych, niemieccy naukowcy stanęli przed zadaniem znalezienia alternatywnej drogi otrzymywania pożądanych azotanów.

Szczęśliwie Cesarstwo Niemieckie - podobnie jak wszystkie inne cesarstwa, sułtanaty, republiki i federacje na naszej planecie - miało dostęp do praktycznie nieograniczonych źródeł pewnego związku azotu. W dodatku takiego, którego nie ograniczają granice państw, cła i limity: związku azotu z azotem, czyli azotu gazowego, głównego składnika atmosfery. Żeby uniknąć nieporozumień, ustalmy, czym się różni jeden azot od azotu drugiego: atomowy azot, oznaczany jako N, jest substancją nieistniejącą w przyrodzie; atom azotu może występować jedynie w połączeniu z drugim atomem azotu, tworząc stabilny azot cząsteczkowy, N  bądź w postaci związków chemicznych z innymi pierwiastkami: od bardzo prostych połączeń z trzema atomami wodoru, jako amoniak, po złożone białka, jak tytyna, której każda cząsteczka składa się z ponad pół miliona precyzyjnie ulokowanych względem siebie atomów węgla, wodoru, tlenu, azotu i siarki. Jednak niezwykła stabilność gazowego azotu powoduje zasadniczy problem: w jaki sposób przekształcić ten powszechny surowiec w coś bardziej przydatnego?
bądź w postaci związków chemicznych z innymi pierwiastkami: od bardzo prostych połączeń z trzema atomami wodoru, jako amoniak, po złożone białka, jak tytyna, której każda cząsteczka składa się z ponad pół miliona precyzyjnie ulokowanych względem siebie atomów węgla, wodoru, tlenu, azotu i siarki. Jednak niezwykła stabilność gazowego azotu powoduje zasadniczy problem: w jaki sposób przekształcić ten powszechny surowiec w coś bardziej przydatnego?
Energochłonne próby ujarzmienia azotu
W przeciwieństwie do tlenu, swojego atmosferycznego partnera biorącego udział w niezliczonych reakcjach spalania, gazowy azot nie reaguje z większością substancji po podgrzaniu w płomieniu palnika. Przeprowadzenie reakcji chemicznej z azotem nie jest jednak niewykonalne - trzeba znaleźć odpowiednio reaktywnego partnera lub dostarczyć reakcji znacznie więcej energii.
Tym drugim tropem poszli dwaj Norwegowie, Kristian Birkeland i Samuel Eyde, którzy na początku XX wieku opracowali metodę przekształcania mieszaniny azotu i tlenu w kwas azotowy(V). W ich procesie gazowy azot i tlen przepuszczane były przez łuk elektryczny, w którym w niewielkim stopniu reagowały ze sobą, tworząc tlenek azotu(II). Ten półprodukt był od razu utleniany do tlenku azotu(IV), a następnie reagował z wodą, tworząc pożądany kwas azotowy(V). Szkopuł w tym, że proces wymagał ciągłego podtrzymywania łuku elektrycznego o temperaturze ponad 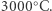 W dodatku całość przepływających gazów musiała być podgrzana do ponad
W dodatku całość przepływających gazów musiała być podgrzana do ponad 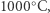 podczas gdy jedynie niewielka ich część faktycznie tworzyła pożądany produkt. Aby uruchomić produkcję kwasu azotowego(V) w dużej skali, Birkeland i Eyde musieli wybudować elektrownię wodną na wodospadzie w Svelgfossen, w południowej Norwegii, zapewniającą im stały dostęp do taniego i pewnego źródła energii elektrycznej. Wynalazcy byli świadomi wad swojego procesu, ale w opisującym proces technologiczny artykule, opublikowanym w 1909 roku, wyrazili przekonanie, że jakiekolwiek ulepszenia ich metody by nie powstały w przyszłości, wszystkie będą najpewniej wymagać ciągłego dostarczania dużych ilości energii.
podczas gdy jedynie niewielka ich część faktycznie tworzyła pożądany produkt. Aby uruchomić produkcję kwasu azotowego(V) w dużej skali, Birkeland i Eyde musieli wybudować elektrownię wodną na wodospadzie w Svelgfossen, w południowej Norwegii, zapewniającą im stały dostęp do taniego i pewnego źródła energii elektrycznej. Wynalazcy byli świadomi wad swojego procesu, ale w opisującym proces technologiczny artykule, opublikowanym w 1909 roku, wyrazili przekonanie, że jakiekolwiek ulepszenia ich metody by nie powstały w przyszłości, wszystkie będą najpewniej wymagać ciągłego dostarczania dużych ilości energii.
Inną drogę obrało dwóch niemieckich chemików, Adolph Frank i Nikodem Caro. W opracowanym przez nich procesie technologicznym gazowy azot był przepuszczany nad gorącym karbidem, czyli węglikiem wapnia. Produktem tej reakcji był cyjanamidek wapnia, stały materiał, który w reakcji z wodą uwalnia amoniak, związek azotu i wodoru. Dalej już było z górki: od 1902 roku znano metodę pozwalającą na utlenienie amoniaku do kwasu azotowego(V). Proces Franka i Caro wymagał dostarczenia energii na początku reakcji; po wstępnym ogrzaniu reaktora do 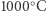 uwalniana w procesie energia wystarczała do podtrzymywania rozpoczętej reakcji. Z tego punktu widzenia metoda Franka i Caro miała przewagę nad konkurencyjnym, wymagającym ciągłego dostarczania energii procesem Norwegów. Problemem był jednak kluczowy surowiec, węglik wapnia, który nie występuje w naturze. Należało go wytworzyć w - a jakże - energochłonnym procesie stapiania dwóch powszechnie dostępnych surowców, wapna i koksu.
uwalniana w procesie energia wystarczała do podtrzymywania rozpoczętej reakcji. Z tego punktu widzenia metoda Franka i Caro miała przewagę nad konkurencyjnym, wymagającym ciągłego dostarczania energii procesem Norwegów. Problemem był jednak kluczowy surowiec, węglik wapnia, który nie występuje w naturze. Należało go wytworzyć w - a jakże - energochłonnym procesie stapiania dwóch powszechnie dostępnych surowców, wapna i koksu.
Fritz Haber kontra termodynamika chemiczna
Równolegle nad bardzo eleganckim rozwiązaniem problemu wiązania gazowego azotu pracował inny niemiecki chemik, Fritz Haber. Jego pomysł opierał się na bezpośredniej reakcji gazowego azotu, obecnego w powietrzu, i gazowego wodoru, produktu gazyfikacji węgla. W wyniku reakcji tych dwóch gazów powstawał amoniak:
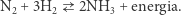
Obliczenia termodynamiczne wskazywały, że pod ciśnieniem atmosferycznym i w temperaturze pokojowej reakcja azotu z wodorem jest samorzutna; w takiej mieszaninie powinien spontanicznie pojawiać się amoniak. I tak z pewnością było, choć ciężko to doświadczalnie stwierdzić, ponieważ we wspomnianych warunkach reakcja ta zachodzi bardzo, bardzo powoli. Podstawową, znaną od dawna metodą przyspieszania reakcji chemicznych jest ogrzanie mieszaniny reakcyjnej. I rzeczywiście, azot i wodór ogrzane do wysokich temperatur tworzą amoniak znacznie szybciej niż w temperaturze pokojowej. Kłopot w tym, że reakcja wodoru z azotem jest odwracalna: amoniak, oczekiwany produkt reakcji, może rozkładać się z powrotem, do wodoru i azotu. I również ta odwrotna, niepożądana reakcja zachodzi szybciej wraz ze wzrostem temperatury. Gdzie w tym sens, może ktoś pomyśleć - z jednej strony ciągle azot i wodór reagują, tworząc amoniak, a z drugiej amoniak w kółko rozpada się na wodór i azot... Ma to jednak ręce i nogi.
Reakcje odwracalne, czyli przebiegające w obie strony, mają to do siebie, że dla danych warunków reakcji istnieje pewna równowaga między ilością reagentów po jednej stronie, w tym przypadku wodoru i azotu, i ilością reagentów po stronie drugiej, czyli amoniaku. W niskiej temperaturze preferowanym produktem jest amoniak, co oznacza, że jeżeli zostawilibyśmy mieszaninę azotu i wodoru odpowiednio długo, znaczna większość gazów początkowych utworzyłaby amoniak. Podniesienie temperatury takiej reakcji znacząco ją przyspiesza, ale jednocześnie, w przypadku niektórych reakcji, w tym reakcji omawianej tutaj, przesuwa ich równowagę w niekorzystną dla nas stronę: azot reaguje z wodorem szybciej, ale produkt reakcji, amoniak, rozpada się jeszcze szybciej i w miarę wzrostu temperatury dysproporcja ta rośnie. Żeby osiągnąć zamierzony cel, należało znaleźć pewien kompromis między wydajnością a szybkością procesu. Niestety w przypadku reakcji azotu z wodorem nie było prosto znaleźć ten złoty środek - każda temperatura pozwalająca na w miarę szybkie ustalenie równowagi była nie do zaakceptowania ze względu na jej niekorzystne położenie.
Część problemu została rozwiązana z pomocą katalizatorów, czyli materiałów, które nie zużywają się w trakcie reakcji i nie zmieniają jej równowagi, ale zwiększają szybkość jej ustalania. Znane Haberowi katalizatory, które mogły przyspieszyć otrzymywanie amoniaku, miały jednak dość wysoką temperaturę aktywacji; w temperaturach niższych po prostu nie działały, a jak pamiętamy, dla wydajności procesu otrzymywania amoniaku tym lepiej, im niższa temperatura. Haber zauważył, że w 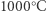 i w obecności katalizatora żelazowego równowaga reakcji zachodzi satysfakcjonująco szybko, ale w mieszaninie gazów pożądany amoniak stanowi niewielki ułamek procenta. Obniżenie temperatury pozwalało zwiększyć ilość produktu, ale dezaktywowało katalizator i przez to dramatycznie zmniejszało szybkość reakcji. I tak źle, i tak niedobrze. Zniechęcony takim wynikiem badań Haber porzucił na pewien czas pracę nad swoim projektem. Rozwiązaniem tego problemu mogło być zwiększenie ciśnienia, w jakim zachodziła reakcja. Ponieważ z danej objętości azotu i trzech równych objętości wodoru powstają dwie objętości gazowego amoniaku, w wyniku zachodzenia reakcji w pożądanym kierunku całkowita objętość mieszaniny malała. A na równowagę takich reakcji korzystnie wpływa zwiększenie ciśnienia, zgodnie z regułą sformułowaną przez Le Chateliera i Brauna. Jednak w pierwszej dekadzie XX wieku wysokociśnieniowe procesy w fazie gazowej nie były dobrze opanowane.
i w obecności katalizatora żelazowego równowaga reakcji zachodzi satysfakcjonująco szybko, ale w mieszaninie gazów pożądany amoniak stanowi niewielki ułamek procenta. Obniżenie temperatury pozwalało zwiększyć ilość produktu, ale dezaktywowało katalizator i przez to dramatycznie zmniejszało szybkość reakcji. I tak źle, i tak niedobrze. Zniechęcony takim wynikiem badań Haber porzucił na pewien czas pracę nad swoim projektem. Rozwiązaniem tego problemu mogło być zwiększenie ciśnienia, w jakim zachodziła reakcja. Ponieważ z danej objętości azotu i trzech równych objętości wodoru powstają dwie objętości gazowego amoniaku, w wyniku zachodzenia reakcji w pożądanym kierunku całkowita objętość mieszaniny malała. A na równowagę takich reakcji korzystnie wpływa zwiększenie ciśnienia, zgodnie z regułą sformułowaną przez Le Chateliera i Brauna. Jednak w pierwszej dekadzie XX wieku wysokociśnieniowe procesy w fazie gazowej nie były dobrze opanowane.
Trzy lata po zawieszeniu projektu, dzięki pomocy brytyjskiego chemika Roberta Le Rossignola, Haber wznowił jednak eksperymenty, tym razem mając do dyspozycji ciśnieniowy reaktor, pozwalający na sprężenie wodoru i azotu do 200 atmosfer i utrzymanie takiego ciśnienia podczas zachodzenia procesu. Pod tak wysokim ciśnieniem udało się przesunąć równowagę nieco w pożądanym kierunku amoniaku. Jednak dopiero znalezienie nowego katalizatora, aktywnego w temperaturze poniżej 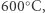 pozwalało osiągnąć wystarczającą wydajność, aby komercjalizacja procesu była opłacalna. Dzięki szeregowi ulepszeń proces, który jeszcze kilka lat wcześniej wydawał się beznadziejnym przypadkiem, pozwalał uzyskać amoniak z gazowego azotu z powietrza z oszałamiającą, jak na owe czasy, wydajnością 5%. Taki proces był już interesujący dla instytucji przemysłowych i nadawał się do prac nad powiększeniem skali i dalszej optymalizacji warunków. Kolejne badania nad katalizatorami pozwoliły zwiększyć wydajność procesu do 15%, a dzięki zastosowaniu systemu zawracania nieprzereagowanego wodoru i azotu do reaktora, całkowita wydajność otrzymywania amoniaku przekroczyła 95%.
pozwalało osiągnąć wystarczającą wydajność, aby komercjalizacja procesu była opłacalna. Dzięki szeregowi ulepszeń proces, który jeszcze kilka lat wcześniej wydawał się beznadziejnym przypadkiem, pozwalał uzyskać amoniak z gazowego azotu z powietrza z oszałamiającą, jak na owe czasy, wydajnością 5%. Taki proces był już interesujący dla instytucji przemysłowych i nadawał się do prac nad powiększeniem skali i dalszej optymalizacji warunków. Kolejne badania nad katalizatorami pozwoliły zwiększyć wydajność procesu do 15%, a dzięki zastosowaniu systemu zawracania nieprzereagowanego wodoru i azotu do reaktora, całkowita wydajność otrzymywania amoniaku przekroczyła 95%.
Nowy rozdział w gospodarce żywieniowej świata
Od uruchomienia wielkoskalowej produkcji w 1913 roku proces Habera zaczął wypierać konkurencyjne procesy wiązania azotu z powietrza - najpierw energochłonną metodę Birkelanda i Eyde'a, a następnie węglikowy proces Franka i Caro. Dwadzieścia lat później był już główną metodą otrzymywania związków azotu z powietrza. Jednocześnie gwałtownie zaczęła rosnąć globalna produkcja związków azotu, co przełożyło się na upowszechnienie nawozów mineralnych - na początku w krajach rozwiniętych, a następnie na całym świecie. W ciągu XX wieku zużycie nawozów azotowych, w przeliczeniu na czysty azot, wzrosło z niecałego pół miliona do prawie 90 milionów ton. Skutkiem tego było znaczące zwiększenie wydajności upraw rolnych na całym świecie, wzrost dostępności żywności i możliwość utrzymania rosnącej populacji na całej planecie.
Proces Habera, po ponad stu latach od opracowania, jest nadal powszechnie stosowany. Odpowiada obecnie za praktycznie całą globalną produkcję amoniaku, który z kolei jest kluczowym surowcem do produkcji innych związków azotu; w 2017 roku wyprodukowano na świecie ponad 150 milionów ton amoniaku. Dotychczas nie znaleziono prostszej i tańszej metody wiązania azotu atmosferycznego. Fascynująca historia tego wynalazku pokazuje, w jaki sposób badania naukowe prowadzone w obrębie jednej dziedziny mogą zrewolucjonizować inne, pozornie niepowiązane gałęzie gospodarki.