Gra w kości atomami
Atomizm ma prastare korzenie, wie to przecież każdy. Jak również każdy wie, że twórcami atomistycznej hipotezy byli Leukip i Demokryt. Nie musi to być jednak prawda; niektórzy greccy filozofowie jej ojcostwo przypisywali legendarnemu fenickiemu protofilozofowi, Mochosowi z Sydonu. A już zapewne mało kto słyszał o atomizmie hinduskim czy (późniejszym) arabskim.

Grecy, z wyjątkiem epikurejczyków, atomizmu nie pokochali; obca była im idea próżni, w której miały się poruszać niezniszczalne atomy. Lukrecjusz w poemacie De rerum natura porzucił pierwotny demokrytejski determinizm ruchu, pisząc o pędzących w próżni atomach, że losowo odchylają swój bieg od prostoliniowego, wskutek czego się zderzają; zjawisko to nazwano parenklizą (clinamen). Ta myśl musiała budzić zgrozę nie mniejszą niż sama idea próżni. W IV wieku naszej ery brawurowo rozprawił się (metodą reductio ad absurdum) z atomami wielce uczony Laktancjusz. Otóż atomy - jak pisał - aby się łączyć, musiałyby mieć jakieś uszka i haczyki, te zaś mogą się łatwo odłamać, co przeczy niezniszczalności atomów. Ergo, nic takiego istnieć nie może.
Na stulecia wygnane z nauki i błąkające się po jej peryferiach, uważane czasem za - wprawdzie użyteczną - ale tylko hipotezę, pełnię obywatelstwa zyskały dopiero dzięki pracy Einsteina o ruchach Browna i doświadczeniu Perrina, a raczej dzięki zgodności doświadczenia z teorią. Na ruchy Browna spojrzeć można jako na spóźnione zwycięstwo lukrecjuszowskiej parenklizy, choć nieco może au rebours. Bo to losowe zderzenia zmieniają prostoliniowy bieg atomów, a nie na odwrót.
Badania nad zjawiskiem promieniotwórczości doprowadziły do wniosku, że atomy muszą mieć jakąś strukturę, w dodatku elektryczną, że zawierają ładunki dodatnie i ujemne. Ale skoro istnieje struktura, to jaka?
Pierwszy model zaproponowany przez Thomsona nazwano modelem ciasta z rodzynkami. Atom miał być rozciągłym obszarem naładowanym dodatnio (ciasto), w którym tkwią ujemne punktowe elektrony (rodzynki). W wyniku różnych zdarzeń elektrony mogą zostać z atomu wybite. Model ten jednak szybko odrzucono, ponieważ nie wyjaśniał poprawnie rozpraszania promieniowania alfa przez materię. Marsden i Geiger rozpraszali cząstki alfa na folii ze złota. Ich wyniki były zgodne z założeniem, że ładunek dodatni nie rozlewa się w atomie w całej jego objętości, ale jest skoncentrowany w niewielkim jądrze otoczonym przez krążące wokół elektrony. Tak narodził się model planetarny Rutherforda.
Historycznie rzecz ujmując, powiemy, że to właśnie owo klasyczne (dziś zaliczane do dziesiątki najpiękniejszych doświadczeń w fizyce) doświadczenie rozproszeniowe wyeliminowało model Thomsona. Mało kto jednak wie, że można go odrzucić również w oparciu o dane spektroskopowe. Model Thomsona można bez trudu skwantować (tak samo jak model planetarny) i znaleźć jego rozwiązanie dla najprostszego przypadku: atomu wodoru. Wtedy możemy przyjąć, że elektron (mający ładunek ujemny) tkwi w środku sferycznie symetrycznej, jednorodnie dodatnio naładowanej kuli, albo wokół tego środka się porusza. O ile tylko elektron nie wyskoczy poza kulę, atom będzie przypominał oscylator harmoniczny.

Jeżeli przez 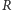 i
i  oznaczymy odpowiednio promień naładowanej dodatnio kuli i masę elektronu, to rozwiązując falowe równanie Schrödingera (Henry Zatzikis, 1958 rok), możemy wyznaczyć poziomy energetyczne. Okazuje się, że są opisane takim samym wzorem (przyjmijmy układ cgs), jaki otrzymujemy dla skwantowanego modelu planetarnego. Numeruje je tylko jedna (naturalna) liczba kwantowa
oznaczymy odpowiednio promień naładowanej dodatnio kuli i masę elektronu, to rozwiązując falowe równanie Schrödingera (Henry Zatzikis, 1958 rok), możemy wyznaczyć poziomy energetyczne. Okazuje się, że są opisane takim samym wzorem (przyjmijmy układ cgs), jaki otrzymujemy dla skwantowanego modelu planetarnego. Numeruje je tylko jedna (naturalna) liczba kwantowa  :
:

gdzie  i
i 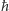 to jak zawsze ładunek elektronu i stała Plancka. Ale uwaga: o ile w modelu planetarnym
to jak zawsze ładunek elektronu i stała Plancka. Ale uwaga: o ile w modelu planetarnym 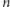 ma dowolną wartość, to w kwantowym modelu Thomsona musi spełniać warunek
ma dowolną wartość, to w kwantowym modelu Thomsona musi spełniać warunek

Można jednak tak dobrać wartość promienia 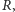 żeby dopuszczalne były wszystkie liczby naturalne. Druga różnica jest już druzgocąca: brak degeneracji. Stany kwantowe atomu wodoru numerowane są przez trzy liczby kwantowe
żeby dopuszczalne były wszystkie liczby naturalne. Druga różnica jest już druzgocąca: brak degeneracji. Stany kwantowe atomu wodoru numerowane są przez trzy liczby kwantowe 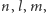 gdzie
gdzie 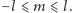 Liczby
Liczby 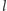 i
i 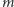 związane są z momentem pędu elektronu. Energia zależy tylko od
związane są z momentem pędu elektronu. Energia zależy tylko od 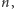 tak więc jednej wartości energii odpowiada kilka poziomów energetycznych. To właśnie nazywamy degeneracją. Okazuje się, że model Thomsona nie dopuszcza rozwiązań o
tak więc jednej wartości energii odpowiada kilka poziomów energetycznych. To właśnie nazywamy degeneracją. Okazuje się, że model Thomsona nie dopuszcza rozwiązań o  I to falsyfikuje go w równym stopniu, co wspomniane doświadczenie rozproszeniowe.
I to falsyfikuje go w równym stopniu, co wspomniane doświadczenie rozproszeniowe.
Mechanika kwantowa, jak wiadomo, zaczęła się od prekwantowego modelu Bohra (1913 rok). Ale nie była to jedyna próba zbudowania jakiegoś prostego modelu atomu. Ta, o której teraz opowiemy, dziś zupełnie zapomniana, jest dziełem amerykańskiego fizykochemika, Gilberta Newtona Lewisa (1875-1946); był on również twórcą nazwy "foton". Model Lewisa został opracowany dużo wcześniej niż model Bohra, jednakże opublikowany dopiero w 1916 roku.
Rzec trzeba od razu, że był on nieco dziwaczny, bo atomy miałyby być sześcianami. Czyżby jednak Bóg grał w kości, w co powątpiewał Einstein? Dokładnie rzecz biorąc, sześcianami miały być powłoki elektronowe; elektrony (w liczbie od 1 do 8) miałyby znajdować się w wierzchołkach sześcianu. W odróżnieniu od Bohra, Lewis przyjmował, że oddziaływanie elektryczne na subatomowych odległościach nie spełnia prawa Coulomba, choć trzeba od razu zaznaczyć, że jego model miał czysto jakościowy charakter i nie pozwalał na żadne obliczenia.
Z punktu widzenia chemii istotna jest tylko ta najbardziej zewnętrzna powłoka, czyli powłoka walencyjna. Te wewnętrzne, całkowicie wypełnione, wchodzą w skład jądra, rozumianego tutaj jako nadwyżka ładunku dodatniego. Jak widać, jądro atomu Lewisa nie jest dokładnie tym samym, czym jest jądro atomu Bohra.
Liczba elektronów na walencyjnej powłoce odpowiadałaby grupie układu okresowego. I tak, atomy grupy pierwszej miałyby mieć na walencyjnym sześcianie jeden elektron, atomy grupy drugiej dwa elektrony i tak dalej...
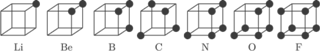
Rys. 1
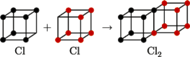
Atomy, dążąc do zapełniania powłok, miałyby też uwspólniać (uszka i haczyki!) elektrony walencyjne. Była to pierwsza, w podstawowym zarysie zachowana do dziś, teoria wiązania kowalencyjnego. Inaczej jednak wyobrażamy sobie uwspólnianie. Rysunki 1 i 2 pokazują pojedyncze oraz podwójne wiązanie kowalencyjne.
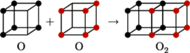
Rys. 2
Model Lewisa obejmował jedynie osiem grup głównych układu okresowego i błędnie przypisywał powłoce walencyjnej helowców osiem elektronów, co zasadniczo jest prawdą, ale nie dla helu, który ma tylko dwa elektrony. Lewis doskonale zdawał sobie sprawę ze słabości swego modelu, podobnie jak z trudności wyjaśnienia powstawania wiązania potrójnego, które wymagało przyjęcia dodatkowej hipotezy (psującej prostotę i elegancję) o łączeniu się elektronów w pary wierzchołkowe i wiązanie trzech sześcianów krawędziami.
Pozostaje jeszcze wyjaśnić, skąd wzięła się ta magiczna ósemka. Chodziło tu o wyjaśnienie tak zwanej reguły Abegga dotyczącej wartościowości pierwiastków. Dziś możemy sformułować ją w języku mechaniki kwantowej następująco. Najtrwalszą konfiguracją jest ta, dla której wypełnione są walencyjne powłoki: 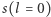 zawierająca
zawierająca 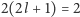 elektrony, oraz
elektrony, oraz 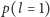 zawierająca
zawierająca 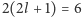 elektronów (liczba
elektronów (liczba 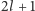 jest degeneracją ze względu na orbitalny moment pędu, a dodatkowa dwójka uwzględnia degenerację ze względu na spin elektronu). A więc razem 8 elektronów. Wyjaśnienie reguły Abegga Lewisowi w ramach jego modelu udało się o tyle, że był on do niej po prostu pomysłowo dopasowany. Tak więc (popuśćmy wodze fantazji) w końcu Lewis musiał przyznać:
jest degeneracją ze względu na orbitalny moment pędu, a dodatkowa dwójka uwzględnia degenerację ze względu na spin elektronu). A więc razem 8 elektronów. Wyjaśnienie reguły Abegga Lewisowi w ramach jego modelu udało się o tyle, że był on do niej po prostu pomysłowo dopasowany. Tak więc (popuśćmy wodze fantazji) w końcu Lewis musiał przyznać:
- Zwyciężyłeś, Austriaku!

Tym Austriakiem był, oczywiście, Schrödinger. W pierwszej chwili chciałem napisać: Duńczyku, ale na szczęście powstrzymałem się w porę. Wszak w odróżnieniu od naiwnego modelu Lewisa, na pozór bardziej wyrafinowany model Bohra zupełnie nie nadawał się do opisu atomów wieloelektronowych, a zatem i wiązań chemicznych!
Dodajmy może jeszcze, że urodzony w 1869 roku w Gdańsku Richard Wilhelm Heinrich Abegg w 1899 roku został profesorem Politechniki Wrocławskiej. Współpracował z Ostwaldem, Ahrreniusem i Nernstem. Prócz chemii pasjonował się fotografią i baloniarstwem, był założycielem Schlesischen Vereins für Luftfahrt. Zginął w kwiecie wieku, w 1910 roku, w wyniku katastrofy balonu Schlesien w pomorskim Cieszynie (Tessin) położonym w pobliżu Koszalina.