Życie na żywo
Im zimno niestraszne

wikipedia
Kur diabeł, ryba arktyczna Myoxocephalus scorpius
Życie można spotkać na Ziemi właściwie wszędzie. Bakterie – w kwaśnej
wodzie wrzących gejzerów, tatusiów-pingwinów stojących przez parę
zimowych miesięcy bez pożywienia, z jajem na nogach, podczas gdy mamusie
wybrały się na posiłek w oceanie. Białe niedźwiedzie pluszczące się wokół kry.
W tej samej wodzie, często o temperaturze poniżej
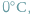 żyją też
zimnokrwiste ryby. Dlaczego nie zamarzają wewnątrz?
żyją też
zimnokrwiste ryby. Dlaczego nie zamarzają wewnątrz?
W ich komórkach istnieje gen kodujący białko, nazwane zgodnie z funkcją antifreeze protein, AFP. Kodujący je gen afp poprzedza tzw. promotor: fragment DNA, który nie koduje białka AFP, ale steruje jego powstawaniem wtedy, gdy temperatura otoczenia zbliża się do temperatury zamarzania wody. Po pobudzeniu przez niską temperaturę genu afp powstaje białko AFP uniemożliwiające zamarzanie płynów ciała ryby. Do niedawna mechanizm tego zjawiska tłumaczono tak: AFP ma powinowactwo do zaczynających się tworzyć w niskiej temperaturze kryształków lodu, będących ośrodkami dalszej krystalizacji, od których rozpoczyna się i przyspiesza przejście wody ciekłej w lód. Kompleksy AFP z takimi ośrodkami krystalizacji hamują powstawanie lodu.
Ale co to znaczy mieć „powinowactwo”?
Na wiele podobnych pytań odpowiada technika dyfrakcji (rozproszenia)
promieniowania X (rentgenowskiego). W tym przypadku metoda okazała się
nieskuteczna, ponieważ intensywność sygnału zależy od liczby elektronów
atomu, który na swej drodze napotykają promienie X. Wodór ma tylko
1 elektron i sygnał dyfrakcji X przez wodę
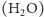 jest prawie równy
sygnałowi samego tlenu. Skoro istnieje taka powierzchnia białka, która wiąże
specyficznie lód, to pomiar dyfrakcji X przez kompleks lód/AFP nie pozwoli
na odróżnienie sygnału wody od tlenu. Z pomocą przyszła technika
dyfrakcji neutronów, wchodzących w skład jąder atomów, w której
siła sygnału zależy od specyficznych sił jądrowych, te z kolei od liczby
neutronów w jądrze, różnej w różnych pierwiastkach, ale także
w izotopach tego samego pierwiastka. Atom wodoru nie ma w jądrze
neutronu, atom deuteru (D, izotop wodoru) jeden neutron ma. Sygnał
dyfrakcji neutronowej deuteru różni się zatem znacząco od sygnału
wodoru. Dzięki temu sygnał „ciężkiej” wody
jest prawie równy
sygnałowi samego tlenu. Skoro istnieje taka powierzchnia białka, która wiąże
specyficznie lód, to pomiar dyfrakcji X przez kompleks lód/AFP nie pozwoli
na odróżnienie sygnału wody od tlenu. Z pomocą przyszła technika
dyfrakcji neutronów, wchodzących w skład jąder atomów, w której
siła sygnału zależy od specyficznych sił jądrowych, te z kolei od liczby
neutronów w jądrze, różnej w różnych pierwiastkach, ale także
w izotopach tego samego pierwiastka. Atom wodoru nie ma w jądrze
neutronu, atom deuteru (D, izotop wodoru) jeden neutron ma. Sygnał
dyfrakcji neutronowej deuteru różni się zatem znacząco od sygnału
wodoru. Dzięki temu sygnał „ciężkiej” wody
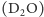 różni się od
sygnału tlenu.
różni się od
sygnału tlenu.
Pewien gatunek bakterii wyposażono w gen afp, hodowano w niskiej temperaturze w ciężkiej wodzie, dzięki czemu deuter wszedł do powstających w bakterii cząsteczek, także do wytwarzanego w dużej ilości białka AFP. Następnie, po wyodrębnieniu, białko to krystalizowano, bo to kryształy poddaje się analizie dyfrakcyjnej. Preparaty białka wytworzonego w zwykłej i ciężkiej wodzie nie różniły się strukturalnie jako kryształy. Z innych badań wiadomo, że struktura kryształów białek jest nieomal identyczna z ich strukturą po rozpuszczeniu w wodzie, zakłada się, że także z ich strukturą w komórce.
Krystaliczna forma białka AFP zasadniczo różni się od większości białek. Ta większość ma tzw. powierzchnie hydrofilowe („lubiące wodę”), które w zwiniętej formie białka, a także w krysztale, wystawione są na zewnątrz cząsteczki, kryjąc wewnątrz powierzchnie o odwrotnej charakterystyce, hydrofobowe („nielubiące wody”). W białku AFP jest na odwrót; hydrofobowe płaszczyzny wystawione są ku środowisku. Tymi płaszczyznami białko AFP wiąże się z kryształami lodu, blokując ich powiększanie się, nie wiąże się z ciekłą wodą. Potwierdzają to skomplikowane badania struktur AFP oddziałującego albo z wodą, albo z lodem.
Nie trzeba było długo czekać na biotechnologiczne zastosowania białka AFP. Używają je w produkcji lodów, aby uzyskać gładką masę. Można gen afp wstawić do genomu roślin wrażliwych na wczesne przymrozki. I można jeszcze wykorzystać promotor afp, dołączając go do genów innych białek, które to geny chcemy pobudzić do aktywności niską temperaturą. Fantazja człowieka nadąża za cudami przyrody, wąską ścieżką praktycznych zastosowań.