Jak to działa?
Kącik biologiczny
Biologiczne komputery
W świecie ożywionym na każdym kroku spotykamy się z przetwarzaniem informacji. Informacje są przetwarzane przez mózgi zwierząt, ale czynią to i pojedyncze komórki podążające za światłem, pożywieniem czy ukrywające się przed drapieżnikami. Fizyk Roger Penrose w „Nowym umyśle cesarza” twierdzi, że gdzieś w neuronach siedzą ukryte komputery kwantowe (zapewne nie ma racji, ale to przywilej specjalisty w jednej dziedzinie – aby mylić się w innej).
Na przeciwnym biegunie złożoności można umieścić równie nieprawdopodobne pomysły Lovelocka, który uważa, iż cała ziemska biosfera razem z geosferą potrafi aktywnie reagować na zmiany kosmicznego środowiska, tak aby utrzymać dogodne warunki dla rozwoju życia na powierzchni Ziemi... Gdzie faktycznie możemy się spotkać z układami przetwarzającymi informację? Kwantowych komputerów w organizmach żywych jeszcze nikt nie znalazł, ale tylko nieco dalej, na poziomie pojedynczych (acz przyznać trzeba – sporych) cząsteczek – możemy znaleźć już to, czego szukamy. Choćby taki przykład – transport tlenu przez krew. Banalna sprawa? Tlen się rozpuszcza we krwi? Ze szkoły pamiętamy, że jest transportowany przez hemoglobinę. Można by przypuszczać, że hemoglobina to tylko taki dobry rozpuszczalnik dla tlenu... Cóż – przyjrzyjmy się temu bliżej.
Pod koniec lat pięćdziesiątych ubiegłego wieku John Kendrew i Max Perutz poznali szczegółową strukturę białek wiążących tlen: mioglobiny i hemoglobiny. Pierwsza jest pojedynczym białkiem, druga składa się z czterech białek – bardzo podobnych do mioglobiny – połączonych w jeden większy kompleks. Cała duża cząsteczka hemoglobiny, składająca się z około 10 000 atomów – potrafi przetransportować... raptem tylko cztery cząsteczki tlenu. Może się to wydać dość rozrzutne, jednak cząsteczka hemoglobiny zachowuje się dość ciekawie. Jeśli choć jedno miejsce wiązania tlenu zostanie zajęte – struktura całego białka zmienia się tak, że pozostałe trzy miejsca łatwiej wiążą kolejne cząsteczki życiodajnego gazu. I odwrotnie – gdy choćby jedno z miejsc aktywnych uwolni cząsteczkę tlenu – pozostałym trzem cząsteczkom łatwiej jest opuścić ten molekularny transporter. Co z tego wynika? Otóż tam gdzie tlenu jest dużo (czyli w płucach) – hemoglobina chętnie tlen wiąże, tam gdzie tlenu jest mało – łatwo go oddaje. Dzięki temu potrafi dostarczyć znacznie więcej tlenu tam, gdzie jest on potrzebny, niż mógłby to zrobić prosty enzym, nie wykazujący takich właściwości.
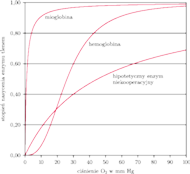
Każda reakcja chemiczna łatwiej zachodzi w obfitości substratu, jednak to, co potrafi hemoglobina, jest czymś więcej niż ta naturalna własność reakcji chemicznych. Nie tylko efekt zostaje wzmocniony dzięki wpływowi każdej z czterech podjednostek wiążących tlen na siebie, ale też zmienia się charakter zależności pomiędzy ilością dostępnego tlenu a wysyceniem nim białka. Tę zależność opisuje krzywa reakcji, która w przypadku mioglobiny jest hiperbolą, a dla hemoglobiny – sigmoidą. Jak widać, to białko wykorzystuje informację o dostępności substratu dla zmiany własności biologicznej maszynki, którą jest... ale to nie wszystko.
Hemoglobina może wiązać produkty pojawiające się w intensywnie
pracujących tkankach w wyniku oddychania komórek:
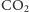 i jony
i jony
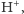 których szczególnie dużo pojawia się w bardzo intensywnie
pracujących mięśniach i wszędzie tam, gdzie brakuje tlenu. Miejsca wiązania
tych cząsteczek znajdują się w różnych miejscach białka. Jednak po ich
związaniu zmienia się kształt całej cząsteczki, tak, że łatwiej uwalnia ona
transportowany tlen. I odwrotnie – związanie tlenu powoduje uwolnienie tak
transportowanych jonów
których szczególnie dużo pojawia się w bardzo intensywnie
pracujących mięśniach i wszędzie tam, gdzie brakuje tlenu. Miejsca wiązania
tych cząsteczek znajdują się w różnych miejscach białka. Jednak po ich
związaniu zmienia się kształt całej cząsteczki, tak, że łatwiej uwalnia ona
transportowany tlen. I odwrotnie – związanie tlenu powoduje uwolnienie tak
transportowanych jonów
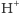 i cząsteczek
i cząsteczek
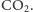 Dzięki temu
efektywnie usuwa ona produkty przemiany materii z pracujących tkanek,
reguluje pH i, co bardzo istotne, cząsteczka hemoglobiny zachowuje się tak, jakby
wiedziała, czy znajduje się w płucach, gdzie tlen ma być związany z nią
możliwie najsilniej, czy w tkankach umiarkowanie pracujących, gdzie należy
uwolnić niewielką ilość tlenu, czy też np. w pracującym mięśniu, gdzie
zapotrzebowanie na tlen jest ogromne i hemoglobina powinna go jak najłatwiej
oddać… Cząsteczka hemoglobiny zachowuje się tak dlatego, że potrafi
integrować informację chemiczną docierającą do niej kilkoma kanałami
i wykorzystywać ją do modyfikacji swoich własności chemicznych. Jest ona
w istocie precyzyjnym urządzeniem biochemicznym przetwarzającym
informacje płynące z otoczenia.
Dzięki temu
efektywnie usuwa ona produkty przemiany materii z pracujących tkanek,
reguluje pH i, co bardzo istotne, cząsteczka hemoglobiny zachowuje się tak, jakby
wiedziała, czy znajduje się w płucach, gdzie tlen ma być związany z nią
możliwie najsilniej, czy w tkankach umiarkowanie pracujących, gdzie należy
uwolnić niewielką ilość tlenu, czy też np. w pracującym mięśniu, gdzie
zapotrzebowanie na tlen jest ogromne i hemoglobina powinna go jak najłatwiej
oddać… Cząsteczka hemoglobiny zachowuje się tak dlatego, że potrafi
integrować informację chemiczną docierającą do niej kilkoma kanałami
i wykorzystywać ją do modyfikacji swoich własności chemicznych. Jest ona
w istocie precyzyjnym urządzeniem biochemicznym przetwarzającym
informacje płynące z otoczenia.
W naturze istnieją tysiące białek, z których znaczna część jest regulowana poprzez chemiczne sygnały docierające z otoczenia. Pojedyncze cząsteczki działają jak najprostsze bramki logiczne AND czy OR, gdy związanie jednego lub większej ilości chemicznych regulatorów uruchamia właściwe funkcjonowanie enzymu. Białka złożone z kilku podjednostek, jak opisana wyżej hemoglobina, potrafią zachowywać się w bardziej skomplikowany sposób. Jak łatwo się domyślić – tam gdzie zacznie oddziaływać na siebie kilka takich cząsteczek – sprawa stanie się bardziej złożona i ciekawsza i o tym będzie w następnym odcinku...