Trzy oszustwa wirusa grypy
Grypa jest chorobą wirusową. Jednak dowiedzieliśmy się o tym stosunkowo niedawno.
Kiedy w 1898 roku panowała pandemia nazywana ,,rosyjskim katarem”, uważano, że chorobę tę powoduje bakteria – Haemophilus influenzae i temu przekonaniu grypa zawdzięcza swoją nazwę w niektórych językach, np. w angielskim „influenza” Okazało się jednak, że to nie bakteria Haemophilus influenzae jest przyczyną grypy, choć często jej obecność towarzyszy chorobie. W latach 30. ubiegłego wieku zidentyfikowano prawdziwego sprawcę choroby – wirusa grypy.
Wirusy to bardzo specyficzne twory chemiczne. W zasadzie trudno nawet nazwać je żywymi, bowiem samodzielnie nie mogą się rozmnażać. Do wytworzenia organizmów potomnych potrzebują komórek gospodarza – zwierzęcia, rośliny czy bakterii. Wirusy są skrajnymi pasożytami: podrzucają swoje geny komórce i zmuszają jej molekularną maszynerię do wytworzenia, w oparciu o zapasy komórki, potomnych wirusów. Cykl życiowy wirusa jest bardzo prosty: wtargnięcie do komórki gospodarza, podrzucenie komórce nielicznych własnych genów – te geny to przepisy na produkcję kilku białek wirusowych, namnożenie genów i białek wirusa, połączenie ich w wirusy potomne, uwolnienie nowych wirusów z komórki gospodarza. Celem wirusa nie jest zabicie komórki, a „tylko” zmuszenie jej do produkcji nowych wirusów.
Wirus grypy ma kształt zbliżony do kuli, a wielkość – około 100 nm (rys. 1). Składa się z genów w postaci kwasu RNA, otoczonych nielicznymi białkami oraz błoną lipidową (czyli tłuszczową), z powierzchni której sterczą jak kolce dwa białka – hemaglutynina i neuramidaza. Są one odpowiedzialne, odpowiednio, za wniknięcie wirusa do komórki i uwolnienie z niej wirusów potomnych. Symbol szczepu wirusa, np. H5N1 w przypadku grypy ptasiej oznacza, że na powierzchni znajduje się hemaglutynina typu 5 i neuramidaza typu 1.
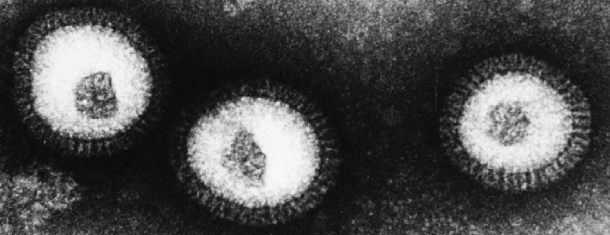
Rys. 1 Wirus grypy widziany w mikroskopie elektronowym (źródło: Ross Hamilton). Widoczne na powierzchni pałeczki to wspomniane w tekście białka: hemaglutynina i neuramidaza.
Przyjrzyjmy się teraz, jak wirus grypy sprytnie oszukuje komórkę w celu wtargnięcia do jej wnętrza i podrzucenia jej swoich genów. W procesie infekcji hemaglutynina wiąże się z cząsteczką cukru – tzw. kwasem sjalowym – będącą receptorem na powierzchni błony komórek gospodarza. Komórka broni się przed niepożądanym ,,gościem” metodą tzw. endocytozy, tj. wpuklenia błony i odcięcia z niej pęcherzyka, tzw. endosomu.
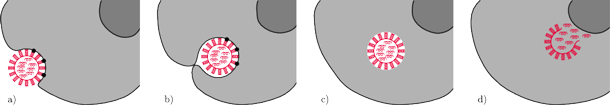
Rys. 2 Pierwsze etapy cyklu życiowego wirusa grypy: a) połączenie hemaglutyniny (pałeczki na powierzchni wirusa) z receptorem – kwasem sjalowym (czarne kropki), b) wniknięcie do komórki drogą endocytozy, c) ucieczka z endosomu i d) podrzucenie komórce genów wirusowych (kolorowe spiralki
Kolejnym krokiem jest przygotowanie intruza do strawienia przez obniżenie pH
wewnątrz endosomu z pH 7 do pH 5 (czyli zwiększenie stężenia protonów
z
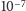 do
do
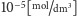 ; dokonuje tego specjalny enzym),
a następnie przyłączenie do endosomu lizosomu dostarczającego enzymy
trawienne (tego nie pokazano na rysunku) i wreszcie strawienie wirusa.
I właśnie ten pierwszy etap – zwiększenie zakwaszenia – „sprytny” wirus grypy
wykorzystuje, aby wymknąć się z pułapki zastawionej na niego przez
komórkę. Powstaje wyścig – kto będzie pierwszy: komórka w trawieniu
wirusa czy wirus w dokonaniu fuzji i podrzuceniu genów.
; dokonuje tego specjalny enzym),
a następnie przyłączenie do endosomu lizosomu dostarczającego enzymy
trawienne (tego nie pokazano na rysunku) i wreszcie strawienie wirusa.
I właśnie ten pierwszy etap – zwiększenie zakwaszenia – „sprytny” wirus grypy
wykorzystuje, aby wymknąć się z pułapki zastawionej na niego przez
komórkę. Powstaje wyścig – kto będzie pierwszy: komórka w trawieniu
wirusa czy wirus w dokonaniu fuzji i podrzuceniu genów.
Rys. 3
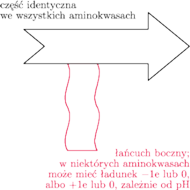
Zanim jednak pokażemy, jak wirus może zwyciężyć w tym wyścigu, przypomnijmy, że białka to długie polimery zbudowane z 20 rodzajów klocków – aminokwasów. Każdy z klocków ma część identyczną jak inne klocki oraz część dla siebie charakterystyczną – tzw. łańcuch boczny (rys. 3). Klocki pasują do siebie, tzn. mogą łączyć się w długie łańcuchy dzięki połączeniu między częściami identycznymi we wszystkich klockach (rys. 4) – powstaje wówczas tzw. wiązanie peptydowe.
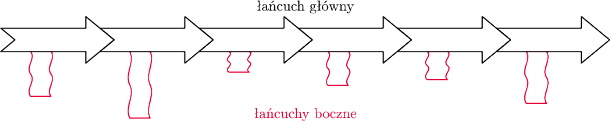
Rys. 4 Łańcuch aminokwasów.
Ponieważ każdy z klocków ma dwa stopnie swobody w łańcuchu głównym, powstający polimer nie jest sztywny i teoretycznie może niemal dowolnie zwijać się w przestrzeni. Okazuje się jednak, że aktywne biologicznie łańcuchy (czyli białka) przyjmują w danych warunkach tylko jedno konkretnie ułożenie, zwane przez biologów konformacją natywną. Pod wpływem zmiany pewnego parametru, np. zmiany zakwaszenia środowiska, w pewnych fragmentach łańcucha może dojść do zmiany tego ułożenia na inne. Mówimy wtedy o dużej zmianie konformacyjnej w strukturze białka.
Wiele białek w formie aktywnej składa się z kilku łańcuchów połączonych słabymi wiązaniami (tzw. niekowalencyjnymi). Hemaglutynina (od tej chwili będziemy ją w skrócie nazywać HA) składa się z trzech identycznych łańcuchów, a każdy z tych łańcuchów zawiera około 550 klocków (rys. 5a).
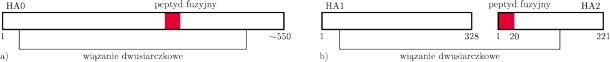
Rys. 5 Schemat budowy hemaglutyniny: a) w formie nieaktywnej tzw. HA0, b) w formie nieaktywnej po przecięciu na dwa fragmenty HA1 i HA2 przez proteazę gospodarza.
W formie, w której znajduje się na powierzchni wirusa, tzw. HA0, hemaglutynina jest nieaktywna – nieszkodliwa dla komórki. Możemy ją porównać do noża ze złożonym ostrzem, zamkniętego w futerale. Aby wirus mógł uciec z endosomu, HA0 musi zostać aktywowana, i to dwukrotnie, tj. w dwóch etapach („wyjęcie z futerału”, „otwarcie ostrza”). Po aktywacji, HA umożliwia połączenie otoczki wirusa z błoną endosomu i wydostanie się materiału genetycznego wirusa z endosomu do wnętrza komórki.
Dzięki czemu dokonuje się owa fuzja, zanim dojdzie do strawienia wirusa? Zrozumienie tego procesu zawdzięczamy połączeniu wielu eksperymentalnych i teoretycznych badań biofizycznych białka HA, a konkretnie rozszyfrowaniu jego atomowej struktury przy zastosowaniu rozpraszania promieniowania rentgenowskiego na kryształach białka oraz zastosowaniu technik molekularnego modelowania do określenia zmian tej struktury pod wpływem zwiększenia zakwaszenia z pH 7 do pH 5.
Rentgenografia i towarzyszące jej badania biochemiczne wykazały, że każdy z trzech łańcuchów białka HA0 jest przecinany na dwa kawałki przez proteazy – enzymy, których rolą jest właśnie rozcinanie łańcuchów białkowych. „Spryt” wirusa polega na tym, że do przecięcia wykorzystuje on proteazę organizmu, który infekuje. Po takim przecięciu powstają dwa fragmenty białkowe – HA1 i HA2 – połączone jednym wiązaniem chemicznym, tzw. mostkiem dwusiarczkowym (Rys. 5b). Jeden z końców fragmentu HA2 (ten uwolniony dzięki cięciu – „wyjęcie noża z futerału”) nazwano peptydem fuzyjnym, bowiem badania biochemiczne i biologiczne jego właściwości udowodniły, że skutecznie może łączyć się z błoną endosomu. Jednak w hemaglutyninie, po przecięciu jej na dwa fragmenty, peptyd fuzyjny ukryty jest nadal głęboko w strukturze przestrzennej białka – ostrze noża jest złożone, co ilustruje rysunek 6 na okładce.
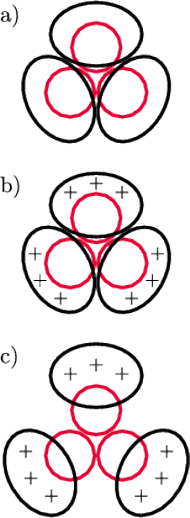
Rys. 8
- a)
- równowaga między HA1 i HA2 w pH 7,
- b)
- zakłócenie równowagi po zakwaszeniu do pH 5 (odpychanie większe od przyciągania),
- c)
- nowa równowaga ustalająca się w pH 5.
Do tej pory nie udało się uzyskać kryształów całej hemaglutyniny w pH 5,
które mogłyby posłużyć do wyznaczenia atomowej struktury HA w pH
panującym w endosomie po zakwaszeniu. Co więcej, atomy wodoru są za lekkie,
aby można je było zobaczyć w klasycznej rentgenografii. W tym miejscu
należy przypomnieć, że klocki tworzące białka różnią się łańcuchami
bocznymi. Niektóre z tych łańcuchów mają łatwo odłączające się od
cząsteczki protony lub miejsca łatwo przyłączające protony. Dlatego też
niektóre z łańcuchów bocznych mogą być w określonych warunkach pH
obdarzone ładunkiem
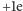 lub 0, a inne
lub 0, a inne
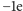 lub 0. Właściwości
elektrostatyczne białka zależą więc silnie od tego, ile ruchliwych protonów jest
przyłączonych do białka.
lub 0. Właściwości
elektrostatyczne białka zależą więc silnie od tego, ile ruchliwych protonów jest
przyłączonych do białka.
Na podstawie znanej struktury atomowej HA w pH 7 obliczono (dla
temperatury
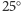 C, tj. 300 K) ilość przyłączonych protonów
ruchliwych, miejsca ich przyłączenia oraz potencjał elektrostatyczny białka
(okładka, Rys. 7.) Okazało się, że HA1 ma potencjał dodatni w zasadzie na całej
powierzchni cząsteczki, podczas gdy HA2 przeciwnie – potencjał ujemny.
Cząsteczki HA1 mają w pH 7 w
C, tj. 300 K) ilość przyłączonych protonów
ruchliwych, miejsca ich przyłączenia oraz potencjał elektrostatyczny białka
(okładka, Rys. 7.) Okazało się, że HA1 ma potencjał dodatni w zasadzie na całej
powierzchni cząsteczki, podczas gdy HA2 przeciwnie – potencjał ujemny.
Cząsteczki HA1 mają w pH 7 w
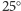 C około 120 ruchliwych protonów,
które dają im wypadkowy ładunek
C około 120 ruchliwych protonów,
które dają im wypadkowy ładunek
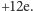 . Natomiast wypadkowy
ładunek HA2 to
. Natomiast wypadkowy
ładunek HA2 to
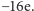 Trzy łańcuchy HA1 i trzy łańcuchy HA2
odpychają się, ale trzymają się razem – odpowiada za to silne elektrostatyczne
przyciąganie HA1 z HA2 (rys. 8a). Jest to jednak stan słabo stabilny (tzw.
metastabilny).
Trzy łańcuchy HA1 i trzy łańcuchy HA2
odpychają się, ale trzymają się razem – odpowiada za to silne elektrostatyczne
przyciąganie HA1 z HA2 (rys. 8a). Jest to jednak stan słabo stabilny (tzw.
metastabilny).
Co zdarzy się, gdy zakwaszenie wzrośnie o dwie jednostki do pH 5,
czyli stężenie protonów w otoczeniu białka wzrośnie z
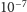 do
do
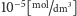 ? Otóż modelowanie pokazuje, że z ładunkiem białka HA2
nie zdarzy się nic szczególnego, ponieważ ukryte jest we wnętrzu HA1 i nie
może wymienić protonów z otaczającym roztworem. Ale HA1 ma kontakt
z roztworem i kiedy pojawi się w nim więcej protonów, HA1 przyjmie
dodatkowo 7 z nich – wypadkowy ładunek wzrośnie do +19e (rys.
8b).
? Otóż modelowanie pokazuje, że z ładunkiem białka HA2
nie zdarzy się nic szczególnego, ponieważ ukryte jest we wnętrzu HA1 i nie
może wymienić protonów z otaczającym roztworem. Ale HA1 ma kontakt
z roztworem i kiedy pojawi się w nim więcej protonów, HA1 przyjmie
dodatkowo 7 z nich – wypadkowy ładunek wzrośnie do +19e (rys.
8b).
Ta zmiana narusza równowagę miedzy HA1 i HA2. Trzy łańcuchy HA1 będą się teraz odpychały na tyle mocno, że nie zrównoważy tego ujemny ładunek HA2. W rezultacie trzy łańcuchy HA1 będą się oddalały od siebie (jak płatki rozwijającego się kwiatu), aż ustali się nowa równowaga między HA2 a HA1 (rys. 8c). W wyniku tego w środku białka tworzy się kanał (co potwierdzają zdjęcia z mikroskopu elektronowego), a ukryty do tej pory we wnętrzu cząsteczki peptyd fuzyjny uzyskuje możliwość wydostania się na zewnątrz. Obliczenia pokazują (a potwierdza je struktura przestrzenna fragmentu białka HA2 wyznaczona metodą dyfrakcyjną), że przemieszcza się on o około 10 nm w kierunku błony endosomu, z którą może dokonać fuzji (okładka, rys. 9). Zatem fuzja umożliwiająca wirusowi wydostanie się z pułapki następuje jako nieuchronny skutek walki komórki z wirusem – zakwaszenia wnętrza endosomu. Ale na tym nie kończy się spryt i przebiegłość wirusa.
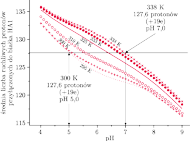
Rys. 10 Zależność średniej liczby protonów przyłączonych do białka HA1 od pH i temperatury (z pracy Huang et al., Biophys. J. 82, 2002, str.1050).
Obliczenia, które opisano powyżej, wykonane zostały dla
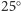 C.
Temperatura ciała zdrowego człowieka to
C.
Temperatura ciała zdrowego człowieka to
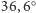 C, natomiast organizmu
walczącego z infekcją wirusem – zwykle kilka stopni więcej. Obliczono (rys. 10),
ile ruchliwych protonów przyłączy HA1 w temperaturach wyższych od
C, natomiast organizmu
walczącego z infekcją wirusem – zwykle kilka stopni więcej. Obliczono (rys. 10),
ile ruchliwych protonów przyłączy HA1 w temperaturach wyższych od
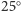 C przy różnych wartościach pH roztworu. I jaki jest wynik? Im
wyższa temperatura, niższe zakwaszenie wystarczy do przyłączenia
owych 120 ruchliwych protonów, które umożliwiają otwarcie noża.
A więc podniesienie temperatury ciała pozwala skalpelowi otwierać się
łatwiej.
C przy różnych wartościach pH roztworu. I jaki jest wynik? Im
wyższa temperatura, niższe zakwaszenie wystarczy do przyłączenia
owych 120 ruchliwych protonów, które umożliwiają otwarcie noża.
A więc podniesienie temperatury ciała pozwala skalpelowi otwierać się
łatwiej.
Wdzieranie się wirusa grypy do komórki można więc podsumować następująco: wirus używa otwieranego elektrostatycznie molekularnego noża – hemaglutyniny. Otwarcia ostrza noża, czyli peptydu fuzyjnego, dokonuje nie wirus, lecz sama zainfekowana komórka, próbując unieszkodliwić wirusa poprzez strawienie go w endosomie. Co więcej, nóż otwiera się łatwiej w wyższej temperaturze, a więc typowa walka organizmu z grypą poprzez podniesienie temperatury ciała pomaga wirusowi uciec z pułapki. Tak więc wirus oszukuje komórkę trzy razy: zaprzęgając ją do wyjęcia noża, otwarcia go i wykorzystując element jej obrony, czyli podniesienie temperatury, do ułatwienia tegoż otwarcia.