Aktualności (nie tylko) fizyczne
Nieopisany mangan
Tlen stanowi (objętościowo) 0,209(4) ziemskiej atmosfery. Tlenu rozpuszczonego w oceanach jest (wagowo) 120 razy mniej. Spalenie wszystkich znanych zasobów węgla i węglowodorów zredukowałoby stężenie tlenu w atmosferze tylko o około 80 punktów bazowych, czyli do około 0,201 (rachunek ten nie uwzględnia jednak węglowodorów uwięzionych w łupkach) [1]...
Cały cząsteczkowy tlen jest ubocznym produktem fotosyntezy. Proces ten uwolnił w ciągu dwóch ostatnich miliardów lat rząd wielkości więcej tlenu, niż wynoszą jego obecne zasoby. Powstało przy tym odpowiednio dużo materii organicznej, która została uwięziona przede wszystkim w łupkach. Tlen ten w większości został zużyty na utlenianie wietrzących się skał [1].
Mniej więcej taki jak obecnie poziom stężenia tlenu został osiągnięty około 550 milionów lat temu, co odpowiada początkowi fanerozoiku (eonu), paleozoiku (ery) i kambru (okresu). Poziom ten jest mniej więcej stały przez cały ten (nadal trwający) eon, choć uczeni badają i dyskutują, co konkretnie to "mniej więcej" oznacza i dlaczego się utrzymuje. Niektóre modele [2] wskazują na podniesienie się stężenia tlenu do około 0,3 w karbonie (około 300 milionów lat temu), wywołane prawdopodobnie wyjątkowym rozwojem roślinności (z tego okresu pochodzą znane złoża węgla kamiennego).
Praktycznie cały tlen powstał poprzez rozkład wody przez sinice, zarówno te funkcjonujące samodzielnie, jak i te będące organellami roślin - chloroplastami (zgodnie z teorią endosymbiozy). Wiemy również, że choć barwników zdolnych do wychwytywania fotonów jest wiele, to pomysł Przyrody na rozkład wody na cząsteczkowy tlen oraz wodór (który jest od razu magazynowany głównie w węglowodanach) jest tylko jeden. Tzw. kompleks rozkładający wodę (ang. water splitting complex lub oxygen evolving complex OEC), który znajduje się w każdym tzw. foto-układzie II (ang. PS II) każdego znanego fotosyntetyzującego organizmu na Ziemi, wykorzystuje atomy manganu, a konkretnie układ (enzym) 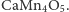
Nie udało się jeszcze w pełni wyjaśnić, dlaczego akurat ten sposób na rozkład wody jest tak efektywny. Mangan jest metalem przejściowym (w tablicy Mendelejewa jest pomiędzy chromem i żelazem, a nad nim jest technet). Jest dość powszechnym pierwiastkiem. W związkach chemicznych występuje na 11. stopniach utlenienia (od 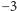 do
do 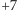 ).
).
Katalizatory manganowe są nieefektywne w wodzie o neutralnym pH. Okazuje się, że kluczem do zwiększenia ich reaktywności jest umożliwienie jednoczesnego odebrania pary elektron-proton (ang. proton-coupled electron transfer PCET) w miejsce reakcji dwustopniowej. Udało się to uzyskać poprzez dodanie pirydyny (lub jeszcze lepiej działających jej pochodnych) jako akceptora protonu (wodoru). Dzięki temu efektywność reakcji za pomocą elektrody 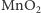 wzrosła o rząd wielkości [3].
wzrosła o rząd wielkości [3].
Nadal jednak jesteśmy daleko od zrozumienia, jak działa enzym 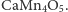 Wiadomo, że dzięki wykorzystaniu energii kolejnych fotonów przechodzi cyklicznie przez pięć stanów oznaczanych od
Wiadomo, że dzięki wykorzystaniu energii kolejnych fotonów przechodzi cyklicznie przez pięć stanów oznaczanych od 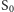 do
do 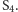 W kolejnych stanach atomy manganu są na coraz wyższych stopniach utlenienia, aż w końcu, powracając do stanu
W kolejnych stanach atomy manganu są na coraz wyższych stopniach utlenienia, aż w końcu, powracając do stanu 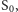 utleniają tlen z cząsteczki wody, zabierając mu elektrony. Można by było się temu zjawisku przyjrzeć za pomocą promieniowania rentgenowskiego. Niestety, promieniowanie to dezintegruje badany obiekt. Trudność tę udało się przezwyciężyć, wykorzystując ultrakrótkie, femtosekundowe impulsy generowane przez tzw. laser na swobodnych elektronach LCLS (ang. Linac Coherent Light Source) działający w SLAC (Stanford, USA).
utleniają tlen z cząsteczki wody, zabierając mu elektrony. Można by było się temu zjawisku przyjrzeć za pomocą promieniowania rentgenowskiego. Niestety, promieniowanie to dezintegruje badany obiekt. Trudność tę udało się przezwyciężyć, wykorzystując ultrakrótkie, femtosekundowe impulsy generowane przez tzw. laser na swobodnych elektronach LCLS (ang. Linac Coherent Light Source) działający w SLAC (Stanford, USA).
Fotografowany był tzw. stan ciemny 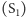 oraz stan po wzbudzeniu dwoma impulsami zwykłego światła (przypuszczalny stan
oraz stan po wzbudzeniu dwoma impulsami zwykłego światła (przypuszczalny stan 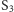 ). Wykonano około stu tysięcy takich rentgenogramów. Ich statystyczna analiza po raz pierwszy pozwoliła na uzyskanie obrazu zmiany konfiguracji elektronowej badanego obiektu [4].
). Wykonano około stu tysięcy takich rentgenogramów. Ich statystyczna analiza po raz pierwszy pozwoliła na uzyskanie obrazu zmiany konfiguracji elektronowej badanego obiektu [4].
Publikacje [3] i [4] to tylko ostatnie dwa przykłady prac wgłębiających się w rolę manganu dla życia na naszej planecie. Badania te mogą równocześnie prowadzić do efektywniejszych metod pozyskiwania tzw. czystej energii.