Leczenie protonami
Strumienie cząstek takich, jak elektrony, protony, cząstki 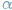 czy neutrony, bądź kwantów promieniowania elektromagnetycznego, jak promienie X, czy
czy neutrony, bądź kwantów promieniowania elektromagnetycznego, jak promienie X, czy 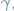 określamy niekiedy wspólną nazwą promieniowania jonizującego. Nazwa pochodzi stąd, że wszystkie wspomniane cząstki czy kwanty przechodząc przez ośrodek materialny oddziałują z jego atomami i cząsteczkami i - bezpośrednio lub pośrednio - wywołują ich jonizację.
określamy niekiedy wspólną nazwą promieniowania jonizującego. Nazwa pochodzi stąd, że wszystkie wspomniane cząstki czy kwanty przechodząc przez ośrodek materialny oddziałują z jego atomami i cząsteczkami i - bezpośrednio lub pośrednio - wywołują ich jonizację.
Mechanizmy procesów prowadzących do jonizacji ośrodka są złożone, a w szczegółach zależą miedzy innymi od struktury chemicznej ośrodka. Promieniowanie jonizujące, przechodząc przez tkankę żywego organizmu i wywołując procesy jonizacji, staje się dla tkanki czynnikiem niszczącym. Takie działanie promieniowania jonizującego czyni je sprzymierzeńcem lekarza onkologa, który - stwierdziwszy u pacjenta obecność nowotworu - dąży do usunięcia lub zniszczenia tkanki nowotworowej.
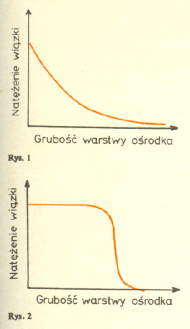
Wiązka promieniowania jonizującego, stosowanego w terapii nowotworów, musi mieć w każdym konkretnym przypadku starannie dobrane wszystkie parametry: energie, natężenie, rozmiary i kierunek. Dobór tych parametrów stanowi wynik stosowania tzw. strategii terapii, w której zakres wchodzi jeszcze jeden, bardzo ważny element, a mianowicie ochrona przed napromieniowaniem zdrowych tkanek, znajdujących się w sąsiedztwie tkanki nowotworowej. Stosowane od dawna w terapii nowotworów promieniowanie elektromagnetyczne (X, 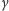 ), a nawet rozpowszechnione w ostatnich latach wiązki elektronów przyspieszanych w betatronach i akceleratorach liniowych oraz neutronów produkowanych w reaktorach ulegają osłabieniu przy przejściu przez ośrodek materialny - według prawa wykładniczego (Rys. 1). Napromienianiu tkanki nowotworowej towarzyszy zatem nieuchronnie napromienianie tkanki zdrowej, znajdującej się dalej na drodze wiązki.
), a nawet rozpowszechnione w ostatnich latach wiązki elektronów przyspieszanych w betatronach i akceleratorach liniowych oraz neutronów produkowanych w reaktorach ulegają osłabieniu przy przejściu przez ośrodek materialny - według prawa wykładniczego (Rys. 1). Napromienianiu tkanki nowotworowej towarzyszy zatem nieuchronnie napromienianie tkanki zdrowej, znajdującej się dalej na drodze wiązki.
Cięższe cząstki naładowane, takie jak mezony 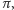 protony czy cząstki
protony czy cząstki 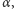 można stosować w terapii, dzięki temu, że cząstki te przy przejściu przez ośrodek osiągają w nim pewna określoną głębokość (zasięg), zależną dla danego ośrodka tylko od energii i rodzaju cząstki (Rys. 2). Własność ta gwarantuje niemal pełne zabezpieczenie tkanek zdrowych znajdujących się poza nowotworem na drodze wiązki.
można stosować w terapii, dzięki temu, że cząstki te przy przejściu przez ośrodek osiągają w nim pewna określoną głębokość (zasięg), zależną dla danego ośrodka tylko od energii i rodzaju cząstki (Rys. 2). Własność ta gwarantuje niemal pełne zabezpieczenie tkanek zdrowych znajdujących się poza nowotworem na drodze wiązki.
Niestety, nieliczne szpitale zajmujące się terapią nowotworów mają dostęp do odpowiednich dla tego celu wiązek cząstek rozpędzanych w akceleratorach. Dla przykładu warto podać, że protony o zasięgu ok. 10 cm w ośrodku tkankopodobnym muszą mieć energię równą prawie 200 MeV. Wiązki protonów o takiej energii stosowane są w terapii nowotworów w niewielu tylko ośrodkach, np. w Szwecji (Uppsala), w ZSRR (Dubna, Zjednoczony Instytuty Badań Jądrowych) i w Wielkiej Brytanii (Glasgow). Projekty zastosowania w terapii onkologicznej mezonów 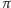 oraz cząstek
oraz cząstek 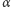 o energiach rzędu GeV są obecnie żywo dyskutowane.
o energiach rzędu GeV są obecnie żywo dyskutowane.
W zagadnieniach tych widzimy kolejny przykład pozornie nieoczekiwanej możliwości praktycznych zastosowań aparatury i wiedzy rozwijanej w badaniach podstawowych z dziedziny fizyki wysokich energii i cząstek elementarnych.