(a) Liczba elektronów równa jest, oczywiście, liczbie protonów w atomach naszego ciała. Każdy gramoatom pierwiastka to 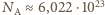 atomów. Gramoatom to liczba gramów pierwiastka równa (z bardzo dobrym przybliżeniem sumie liczb protonów i neutronów jądra atomu). Ciało człowieka zbudowane jest głównie z atomów tlenu, węgla wodoru, azotu. Poza wodorem wymienione pierwiastki występują niemal wyłącznie w postaci izotopów o równej liczbie protonów i neutronów, a więc w każdym ich gramoatomie mamy
atomów. Gramoatom to liczba gramów pierwiastka równa (z bardzo dobrym przybliżeniem sumie liczb protonów i neutronów jądra atomu). Ciało człowieka zbudowane jest głównie z atomów tlenu, węgla wodoru, azotu. Poza wodorem wymienione pierwiastki występują niemal wyłącznie w postaci izotopów o równej liczbie protonów i neutronów, a więc w każdym ich gramoatomie mamy 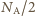 protonów. Wodór to niemal wyłącznie izotop
protonów. Wodór to niemal wyłącznie izotop 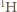 najczęściej związany w cząsteczkach wody (stanowiącej składnik żywych komórek). W cząsteczce wody mamy 10 protonów i 8 neutronów, co oznacza, że jeśli pominiemy niewielką różnicę mas protonu i neutronu, to
najczęściej związany w cząsteczkach wody (stanowiącej składnik żywych komórek). W cząsteczce wody mamy 10 protonów i 8 neutronów, co oznacza, że jeśli pominiemy niewielką różnicę mas protonu i neutronu, to 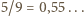 masy wody przypada na protony. Z dokładnością do
masy wody przypada na protony. Z dokładnością do 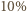 możemy więc przyjąć, że średnio 1 g naszego ciała zawiera około
możemy więc przyjąć, że średnio 1 g naszego ciała zawiera około 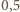 g protonów, a więc około
g protonów, a więc około 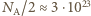 protonów i tyle samo elektronów.
protonów i tyle samo elektronów.
(b) Stosunek liczby protonów do liczby wszystkich nukleonów w jądrze jest dla większości naturalnie występujących izotopów bliski 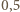 i nieznacznie maleje ze wzrostem liczby atomowej do około 0,39 dla
i nieznacznie maleje ze wzrostem liczby atomowej do około 0,39 dla 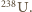 Wyjątek (patrz (a)) stanowi wodór, który niemal wyłącznie występuje jako izotop
Wyjątek (patrz (a)) stanowi wodór, który niemal wyłącznie występuje jako izotop 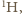 ale stanowi on niewielką część masy otaczających nas substancji (np. tylko 10% masy wody). Zatem dla otaczającej nas materii wynik jest taki sam, jak dla naszego ciała.
ale stanowi on niewielką część masy otaczających nas substancji (np. tylko 10% masy wody). Zatem dla otaczającej nas materii wynik jest taki sam, jak dla naszego ciała.